Schwefelsäure#
von Marko ZlokarnikSchwefelsäure (H2SO4, Dihydrogensulfat) ist eines der Schlüsselprodukte der chemischen Industrie. Sie wird hauptsächlich zur Produktion von Phosphor- und Stickstoff-Düngemitteln, zur Darstellung anderer Mineralsäuren wie Salz- und Phosphorsäure, sowie als Reaktionspartner in der organischen Synthese eingesetzt. In 1980 betrug die Welt-Produktion 137,3 Mio. t 100 %-ige H2SO4, im Jahre 2012 aber bereits 230,7 Mio. t. Dabei entfielen auf Europa 19, auf die USA 35,8 und auf Russland 8,6 Mio. t. Die Produktion von H2SO4 ist ein Gradmesser für den Leistungsstand der chemischen Industrie des jeweiligen Landes. Für das Ende des Jahres 2015 wurde die Produktionskapazität von 257,6 Mio. t erwartet.
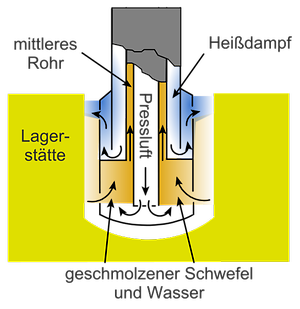
(A) Als Ausgangsprodukt werden verschiedene Stoffe verwendet. Es fing mit elementarem Schwefel (S) an. Er kommt in der Natur in sedimentären Lagerstätten (Sizilien!) und in den Schwefellagern von Louisiana und Texas in den USA vor. Hier wurde er nach dem Hermann Frasch – Verfahren (1891) gewonnen. Hierzu werden in das Bohrloch drei koaxiale Rohre getrieben, die in einem Fußkörper enden, dessen Ausführung aus Abb. 1 ersichtlich ist. Durch den äußeren Ringraum wird heißes Wasser (40 bar, ca. 165°C unter Druck, ca. 25 bar) in die Lagerstätte eingepresst und der geschmolzene Schwefel (Schmelzpunkt 119,6°C) zusammen mit Wasser durch den mittleren Ringraum zur Erdoberfläche getrieben. Dazu hilft die Pressluft (40 bar), die durch das innere Rohr eingeleitet wird. Von der Schwefelproduktion (1980) von 37,9 Mio. t entfielen auf den Frasch-Schwefel in den USA 6,31 Mio. t. Die USA haben diese Produktion im Jahre 2001 eingestellt, nachdem auch das letzte abzubauende Vorkommen nicht mehr wirtschaftlich war.
Eine weitere bedeutende Quelle zur Gewinnung von Schwefel bzw. von Schwefeldioxyd SO2sind die sulfidischen Erze, meist Pyrit („Schwefelkies“) FeS2. Das Rösten (Oxidation) des Erzes wird in Etagenröstöfen (1) bei Temperaturen von 800 - 850°C entsprechend der Beziehung 2 FeS2+ 5,5 O2 = Fe2O3 + 4 SO2; ∆H = - 1660 kJ/Mol durchgeführt. (In Deutschland waren Pyrit-Grube in Meggen (Sauerland) sowie Grube Bayerland (Oberpfalz) bedeutend. Beide sind seit den 70er und 80er Jahren stillgelegt. Da der Abbrand der meisten Pyrite von deutschen Lagerstätten Kupfer (oft auch Zink) enthielt, wurde der Abbrand in der dafür gebauten >Kupferhütte Duisburg< am Rhein weiter behandelt.
Heute sind die bedeutendsten Quellen für Schwefel das Erdgas und das Erdöl mit 16,95 Mio. t im Jahr 1980. In diesen Stoffen liegt Schwefel in Form von Schwefelwasserstoff vor.
Aus dem Schwefelwasserstoff H2S, welcher im Erdgas, Raffinerie-, Synthese- und Koksofengas enthalten ist, wird elementares S durch Oxidation nach dem Claus-Prozess gewonnen. Folgende zwei Reaktionen laufen ab:
2H2S + O2= S2 + 2 H2O und 2H2S + SO2↔ ⅜ S8+ 2 H2O
Das Prozessgas wird im ersten Reaktor auf etwa 300°C abgekühlt und die H2S- Umsetzung bis zu 80 – 85 % an einem Kobalt-Molybdän-Katalysator durch-geführt. Nach Auskondensieren des gebildeten Schwefels bei T < 170°C erfolgt die zweite Reaktion im zweiten Reaktor bei ca. 220°C am hochaktiven Aluminium-Katalysator (3). Schwefel-Ausbeuten liegen bei 96 – 98 %.
(B) Die Umsetzung von Schwefel bzw. Schwefeldioxyd zu Schwefelsäure erfolgt in folgenden Schritten:
S + O2 = SO2 SO2 + ½ O2 = SO3 SO3 + H2O = H2SO4
Es gibt drei Verfahren zur Gewinnung von Schwefelsäure, von denen heute im Wesentlichen nur noch das dritte betrieben wird.
Das erste Verfahren war das Bleikammerverfahren („Stickoxidverfahren“, um 1820). Er wird in (1) auf 5, in (2) auf 17 Seiten dargestellt. Die Chemie wird mit folgender Formel beschrieben: SO2 + 2 NO + ½ O2 + H2O = H2 SO4 + 2 NO. Das bedeutet, dass hier das NO als Katalysator, als Sauerstoffüberträger fungiert. Die Oxydationsreaktion verläuft in flüssiger Phase, deren primärer Träger die salpetrige Säure HNO2 ist. Die technische Anlage besteht aus drei Bleikammern, die von diesen Gasen durchströmt werden. Die erste arbeitet bei 80°C und setzt etwa 70 % des SO2 zu Schwefelsäure um. Die weiteren Kammern arbeiten bei absinkenden Temperaturen von 40°C auf 30°C. Die Reaktion ist exotherm, die Wärme wird durch die Kammerwände abgeführt. Es wird eine 62,5 %ige H2SO4 (50°Bé) gewonnen (°Bé = Baume-Grade).
Das zweite Verfahren (entwickelt um das Jahr 1900) war Jahrzehnte lang das wichtigste. Es handelt sich um das Kontaktverfahren, bei dem die Reaktion SO2 + ½ O2 = SO3 ; ∆H = - 98,2 kJ/Mol (23,45 kcal/Mol) abläuft. Als Katalysator wird Vanadiumpentoxid verwendet. Es ist eine Salzschmelze aus Vanadiumsulfat und Kaliumpyrosulfat, die auf porösem Träger (Kieselgur oder Diatomeenerde) aufgetragen ist.
Die untere Arbeitstemperatur des Katalysators liegt bei 420 bis 440°C, die obere bei 620°C. Die katalytische Oxidation von SO2 zu SO3 ist eine heterogen-katalytische stark exotherme Gleichgewichtsreaktion. Um den größtmöglichen Umsatz zu erzielen, muss die Reaktion in mehreren Stufen durchgeführt werden und das Gas muss zwischen den Stufen gekühlt werden. Die Oxidation erfolgt an Hordenkontakten (Horde = Boden). In der Kolonne befinden sich vier bis fünf Siebböden, auf denen die Katalysatormasse aufgeschüttet ist. Das SO2-haltige Gas wird mit trockener Luft auf ca. 10 % SO2 eingestellt und durchströmt die obere erste Horde mit einer Temperatur von 450°C. Dabei wird es auf ca. 620°C erwärmt. Vor dem Eintritt in die darunterliegende 2. Stufe muss es auf 450°C abgekühlt werden. Das passiert auch bei den weiteren Stufen, s. Abb. 2, welche den SO2 – Umsatz in den einzelnen Horden anzeigt. Nach der vierten Horde ist der maximal mögliche Umsatz von 98 % (bezogen auf SO2) erreicht. Die Reaktion ist stark exotherm, das Gas muss zwischen den Horden gekühlt werden. Die freiwerdende Reaktionswärme wird zur Erzeugung von Hochdruckdampf (400°C und 40 bar) genutzt, der zur Stromerzeugung dient.
Das dritte, heute praktisch überall angewendete Verfahren heißt das Dopeltkontaktverfahren, das von der Fa. BAYER, D - Leverkusen in den 1950er Jahren entwickelt wurde. Wenn nach der dritten Horde (Umsatz 90 – 93 %) das gebildete SO3 durch eine Zwischenabsorption in einer 98,5 – 99 %igen H2SO4 aus dem System entfernt wird, kann anschließend das verbliebene SO2 in der vierten Horde zu 99,6 – 99,7 % umgesetzt werden. Abb. 3 zeigt das Schema einer H2SO4 – Produktionsanlage mit Schwefelverbrennung und Doppelkatalyse und belegt eindrucksvoll, welchen technischen Aufwand eine relativ einfache chemische Umsetzung nach sich zieht, damit sie wirtschaftlich und umweltverträglich durchgeführt wird.
Literatur#
(1) Ost-Rassow: "Lehrbuch der Chemischen Technologie" 26. Auflage, 1269 Seiten. Johann Ambrosius Barth-Verlag-Leipzig, 1955.(2) Dr. Bernhard Neumann: "Lehrbuch der Chemischen Technologie" 3. Auflage, Verlag Julius Springer, Berlin 1939. -- Band 1: Brennstoffe, Anorganische Industriezweige, 585 Seiten.
(3) Büchner – Schliebs – Winter – Büchel: "Industrielle Anorganische Chemie". Zweite, durchgesehene Auflage, VCH D-Weinheim, 1986. Seiten 112 - 128
(4) Beitrag Schwefel in AustriaWiki
(5) Beitrag Schwefeläure in AustriaWiki
Weiterführendes#
- Chemie (Thema)
- Prozessentwicklung (Thema)