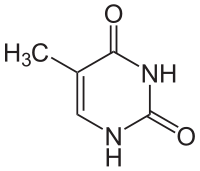
Thymin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 |
||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Thymin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C5H6N2O2 | |||||||||||||||||||||
| Kurzbeschreibung | weißer, kristalliner Feststoff[2] |
|||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
|
||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 126,04 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest |
|||||||||||||||||||||
| Dichte | 1,46 g·cm−3[3] |
|||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | schwer löslich in kaltem Wasser, löslich in heißem Wasser und verdünnten Alkalihydroxid-Lösungen[4] |
|||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
|
||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Thymin (T, Thy, 5-Methyluracil) ist eine der vier Nukleinbasen in der DNA, zusammen mit Adenin, Cytosin und Guanin. In der RNA steht an seiner Stelle Uracil. Es ist eine heterocyclische organische Verbindung mit einem Pyrimidingrundgerüst und drei Substituenten (Sauerstoffatome an den Positionen 2 und 4, Methylgruppe an Position 5). Die Nukleoside von Thymin sind das Desoxythymidin in der DNA und das seltene Ribothymidin in der RNA (z. B. in der tRNA). In der Watson-Crick-Basenpaarung bildet es zwei Wasserstoffbrücken mit Adenin.
Darstellung und Gewinnung
Eine Isolierung kann aus Rinderhirnen oder Kabeljau-Rogen erfolgen.[5][6]
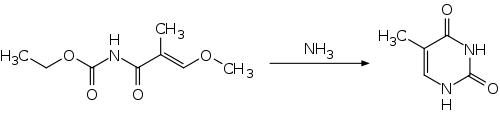
Eine synthetische Darstellung gelingt durch Cyclisierung von N-Ethoxycarbonyl-3-methoxy-2-methylacrylamid in wässriger Ammoniaklösung.[7]
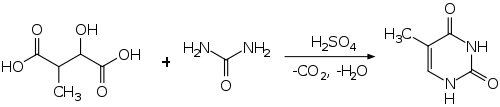
Eine weitere Synthese geht von 3-Methyläpfelsäure aus, welche in rauchender Schwefelsäure decarboxyliert und mit Harnstoff kondensiert wird.[8]
Eigenschaften
Physikalische Eigenschaften
Thymin bildet glänzende, bitter schmeckende, nadelförmige oder prismenförmige Kristalle[9], die bei 335–337 °C unter Zersetzung schmelzen.[10] Die Verbindung löst sich gut in heißem Wasser, in Alkohol und Ether ist die Löslichkeit gering.[9] In alkalischen Medien löst es sich unter Salzbildung infolge einer Enolatbildung abgeleitet von der Enolform 5-Methyl-2,4-pyrimidindiol.[10]
Chemische Eigenschaften
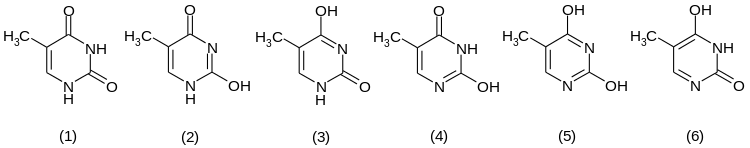
Prinzipiell kann Thymin in sechs tautomeren Strukturen vorliegen. Die Lactamform (1) wird aber gegenüber den Enolformen bevorzugt.[11]
Geschichte und biologische Bedeutung
1893 berichtete der spätere Nobelpreisträger Albrecht Kossel von einer Entdeckung. Aus den Thymusdrüsen des Kalbes hatte er mit dem Assistenten Albert Neumann Nukleinsäure gewonnen und mit Schwefelsäure behandelt. Es bildete sich ein gut kristallisiertes Spaltprodukt, für das – abgeleitet von der Thymusdrüse – der Name Thymin vorgeschlagen wurde.[12][13]
Thymin kann Bestandteil der DNA oder verschiedener Nukleoside und Nukleotide sein.
Nukleoside
Über das N1-Atom des Ringes kann Thymin an das C1-Atom der Desoxyribose N-glycosidisch gebunden werden; man spricht dann von einem Nukleosid, dem Desoxythymidin. Bei der Bindung an Ribose entsteht das Nukleosid Ribothymidin.
-
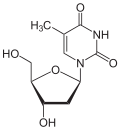

Desoxythymidin, dT Ribothymidin, T
Nukleotide
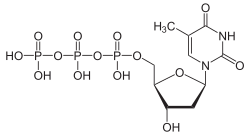
Über die Phosphorylierung des Thymidins am C5-Atom der Ribose gelangt man zu den wichtigen Nukleotiden Desoxythymidinmonophosphat (dTMP), Desoxythymidindiphosphat (dTDP) und Desoxythymidintriphosphat (dTTP).
Bestandteil der DNA
In der DNA-Doppelhelix bildet Thymin über die 4-Oxogruppe und die N3–H-Gruppe zwei Wasserstoffbrücken mit der zugehörigen Adenin-Base des komplementären Stranges aus.
Vergleich von Thymin und Uracil
In der DNA tritt Thymin an die Stelle von Uracil. Uracil kann relativ einfach durch Desaminierung und Hydrolyse aus Cytosin entstehen, wodurch dann die Basensequenz geändert (mutiert) und die in der Nukleotidsequenz genetisch codierte Information womöglich verändert wird.
Thymin hingegen unterscheidet sich vom Uracil durch eine zusätzliche Methylgruppe und kann so auch nicht ohne weiteres aus Cytosin entstehen. In der DNA vorhandenes Uracil kann somit als Mutation erkannt und durch Basenexzisionsreparatur gegen Cytosin ausgetauscht werden.
Thymindimer
Bei Thymindimeren handelt es sich um eine DNA-Mutation, welche durch UV-Strahlung induziert wird. Dabei verbinden sich zwei auf einem DNA-Strang nebeneinanderliegende Thymin-Basen über eine [2+2]-Cycloaddition kovalent zu einem Dimer, das ein relativ stabiles Cyclobutan-Derivat ist.[14]
-

Bildung eines Thymindimers [15]
Besonders anfällig für eine solche Mutation sind Hautzellen, die dem Sonnenlicht ausgesetzt sind. Aus diesem Grund werden Thymindimere als eine wesentliche Ursache für die Entstehung von Hautkrebs diskutiert.[16]
Verwendung
Thymin dient als Ausgangsstoff für einige Arzneistoffe wie z. B. Zidovudin, Telbivudin und Clevudin.
Verwandte Verbindungen
 |
 |
| Uracil | 3-Methyluracil |
Weblinks
- Eintrag zu Thymine in der Human Metabolome Database (HMDB), abgerufen am 18. November 2013.
Einzelnachweise
- ↑ Eintrag zu THYMINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- 1 2 3 4 Datenblatt Thymin bei AlfaAesar, abgerufen am 23. November 2013 (PDF) (JavaScript erforderlich).
- ↑ K. Ozeki, N. Sakabe, J. Tanaka: „The crystal structure of thymine“, in: Acta Cryst., 1969, B25, S. 1038 (doi:10.1107/S0567740869003505).
- ↑ Europäisches Arzneibuch 10.0. Deutscher Apotheker Verlag, 2020, ISBN 978-3-7692-7515-5, S. 941.
- ↑ Shimizu: Biochem. Zeitschrift, 1921, 117, S. 262.
- ↑ König, Grossfeld: Biochem. Zeitschrift, 1913, 54, S. 371.
- ↑ G. Shaw, R. N. Warrener: „33. Purines, pyrimidines, and glyoxalines. Part VIII. New syntheses of uracils and thymines“, in: J. Chem. Soc., 1958, S. 157–161 (doi:10.1039/jr9580000157).
- ↑ H. W. Scherp: „Convenient Syntheses of Thymine and 5-Methylisocytosine“, in: J. Am. Chem. Soc., 1946, 68, S. 912–913 (doi:10.1021/ja01209a510).
- 1 2 Brockhaus ABC Chemie, Verlag Harri Deutsch Frankfurt/Main und Zürich 1965.
- 1 2 Eintrag zu Thymin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. Dezember 2014.
- ↑ S. Hauptmann, J. Gräfe, H. Remane: Lehrbuch der organischen Chemie, VEB Deutscher Verlag der Grundstoffindustrie, Leipzig 1980, S. 556.
- ↑ Kossel, A. und A. Neumann: Über das Thymin, ein Spaltungsproduct der Nucleinsäure. In: Berichte der Deutschen Chemischen Gesellschaft, Band 26, 1893, S. 2753
- ↑ Kossel, A. und A. Neumann: Darstellung und Spaltungsproducte der Nucleinsäure (Adenylsäure). Vortrag in: Berichte der Deutschen Chemischen Gesellschaft, Band 27, 1894, S. 2215.
- ↑ Durbeej, B.; Eriksson, L.A.: Reaction mechanism of thymine dimer formation in DNA induced by UV light in J. Photochem. Photobiol. A: Chem. 152 (2002) 95–101, doi:10.1016/S1010-6030(02)00180-6.
- ↑ K. Peter C. Vollhardt, Neil E. Schore: Organische Chemie, 4. Auflage, Wiley-VCH, Weinheim 2005, ISBN 3-527-31380-X, S. 181.
- ↑ Alberts, Bray, Johnson, Lewis: Lehrbuch der molekularen Zellbiologie, 2. korrigierte Auflage, Wiley-VCH, Weinheim 2001, ISBN 3-527-30493-2.