Enzymatische Metallzentren – was zähmt das brennende Herz?#
von
Grit Straganz
Institut für Biotechnologie und Bioprozesstechnik

Grit Straganz ist Universitätsassistentin am Institut für Biotechnologie und Bioprozesstechnik. Straganz´ postgraduale Forschung konzentriert sich auf die Mechanismen Sauerstoffabhängiger Reaktionen an enzymatischen Metallzentren. Seit 2006 werden diese Studien im Rahmen eines FWF-Projektes finanziert.
© Forschungsjournal 2008/12
Meine Forschung befasst sich mit den molekularen Vorgängen Sauerstoff-abhängiger biologischer Katalyse, mit Schwerpunkt auf der Funktion von Metall-Enzymen. Ein tiefes Verständnis der Mechanismen dieser vielseitigen Proteine bildet die Grundlage für die Entdeckung und Entwicklung neuartiger Enzymreaktionen, mit dem Ziel, Feinchemikalien und Pharmazeutika mit Hilfe von hochselektiven Sauerstoff-abhängigen Reaktionen zu synthetisieren.
Etwas zu verbrennen erscheint uns als recht einfache Aufgabe. Man entfacht etwa ein Streichholz und zündet damit eine Zigarette an. Allerdings wirkt das Verbrennen hier destruktiv, nicht schöpferisch. Die Flamme wird den umgebenen Sauerstoff verzehren (reduzieren) und das ‚wertvolle‘ organische Material zu Kohlendioxid und Russ verwandeln (oxidieren). Und wie sieht es aus, wenn Chemiker Sauerstoff verwenden, um organische Moleküle zu oxidieren? Nicht viel besser. Die Sauerstoff-abhängigen Reaktionen sind schwer zu kontrollieren und führen gewöhnlich zu Produktgemischen.
© Forschungsjournal 2008/12 / Grit Straganz
© Forschungsjournal 2008/12 / Grit Straganz
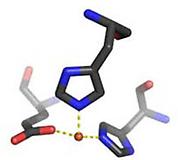
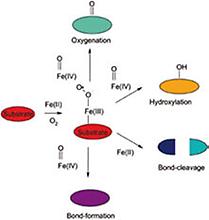
Während sich die MNHEs bezüglich ihres Metallzentrums und des Prinzips der Sauerstoff-Aktivierung gleichen, besteht eine Vielfalt von möglichen Reaktionswegen beim Zerfall des O2-Intermediates (Abb. 1b). Diese Wege werden vom feinen Zusammenspiel von Substrat, Proteinumgebung und resultierendem Oxidationszustand des Eisens bestimmt, was noch wenig erforscht ist.
Ein System, das ich untersuche, um dieses Zusammenspiel aufzuklären, ist das Enzym Dke1, eine neuartige MNHE-Dioxygenase, die in meiner Doktorarbeit gefunden, kloniert und biochemisch charakterisiert wurde. Detaillierte mechanistische Studien führten zum erstmaligen direkten Beweis, (i) dass die Sauerstoff-Reduktionsraten am Metallzentrum direkt und quantitativ von der Substratstruktur abhängen und (ii) ebenso das C-C Spaltungsmuster. Auf Basis dieser Studien wurde ein Mechanismus der Dicarbonylspaltung in Dke1 vorgeschlagen. Die Arbeit wurde mit dem "Anton Paar Wissenschaftspreis" ausgezeichnet.
© Forschungsjournal 2008/12 / Grit Straganz
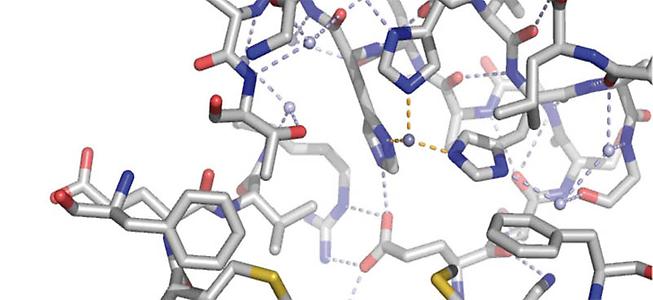
Das Metallzentrum von Dke1 wurde während meines einjährigen Forschungsaufenthaltes an
der Stanford University (USA) auch spektroskopisch untersucht: Dke1 zeigt eine untypische Metallbindungsstelle, drei Hisidine binden das Eisen (Abb. 2). In Stanford untersuchten wir die Frage, welche Rolle das jeweilige Bindungsmotiv in der Katalyse und vor allem bezüglich des Mechanismus der Sauerstoff-Aktivierung spielt.
Weitere Studien befassen sich damit, den Einfluss der Proteinumgebung auf den Reaktionsweg MNHEs zu charakterisieren und die Proteinstruktur gezielt zu verändern, mit dem Ziel neue Enzymreaktionen zu designen.