Endosymbiontentheorie
schwarz: Zell- oder Organellmembran;
rosa: eukaryotische DNA;
grün: cyanobakterielle DNA;
rot: proteobakterielle oder mitochondriale DNA
Die Endosymbiontentheorie (altgriechisch ἔνδον éndon ‚innen‘ und συμβίωσις symbíōsis ‚Zusammenleben‘) besagt, dass Eukaryoten aus einer Endosymbiose prokaryotischer Vorläuferorganismen hervorgegangen sind. Demnach sind chemo- und phototrophe Bakterien von Archaeen aufgenommen worden, in denen sie sich zu Zellorganellen ihrer Wirtszellen entwickelt haben, darunter Mitochondrien und Plastiden. Allerdings gibt es auch Eukaryoten, die weder Zellatmung noch Photosynthese betreiben und keine derartigen Organellen haben, wobei angenommen wird, dass diese Zellbestandteile nachträglich verloren gegangen sind.
Geschichte
Der Gedanke der Endosymbiontentheorie ist erstmals von dem Botaniker Andreas Franz Wilhelm Schimper im Jahr 1883 veröffentlicht worden, der damit die Entstehung der Chloroplasten zu erklären versuchte.[1] Ähnliche Ideen vertreten zur damaligen Zeit Julius Sachs und Richard Altmann.[2] Die Hypothese wurde erneut 1905 von dem russischen Evolutionsbiologen Konstantin S. Mereschkowski,[3] 1922 von Ivan Wallin[4][5] und 1924 von Boris Koso-Poljanski aufgegriffen. Doch erst 1967 mit der Veröffentlichung von Lynn Margulis wurde sie bekannter.[6][7][8][9][10]
Erläuterung
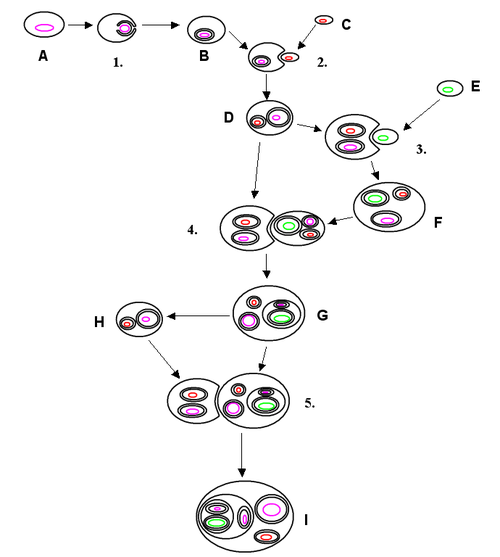
Die Endosymbiontentheorie geht davon aus, dass Mitochondrien und Plastiden sich aus eigenständigen prokaryotischen Lebewesen entwickelt haben. Im Zuge des Evolutionsprozesses sind diese Einzeller eine Endosymbiose mit einer anderen Zelle eingegangen, das heißt, sie leben in ihrer Wirtszelle zum gegenseitigen Vorteil. Auch heute noch kann man beobachten, dass amöboide Einzeller (also solche mit einer „weichen“ Membran) Cyanobakterien aufnehmen, ohne sie zu verdauen.
Das Zusammenspiel der beiden zellulären Organismen hat sich dann im Verlauf der Evolution zu einer gegenseitigen Abhängigkeit entwickelt, in der keiner der beiden Partner mehr ohne den anderen überleben konnte, das heißt, es entstand eine Symbiose. Diese wird Endosymbiose genannt. Die Abhängigkeit geht so weit, dass die Organellen Teile ihres (nicht mehr benötigten) genetischen Materials verloren haben oder die entsprechenden Gene teilweise in das Kern-Genom integriert wurden. Einzelne Protein-Komplexe in den Organellen, wie z. B. die ATP-Synthase, werden so zum Teil aus kerncodierten, zum Teil aus mitochondrial codierten Untereinheiten zusammengesetzt.
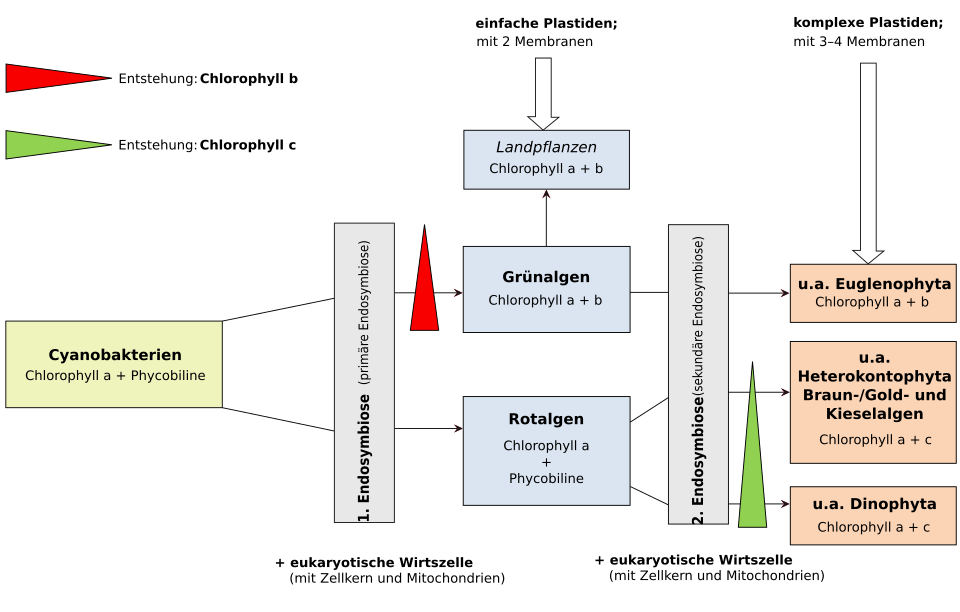
Analysen der Genome deuten darauf hin, dass Plastiden von Cyanobakterien abstammen, während Mitochondrien von aeroben α-Proteobakterien (früher favorisiert: Rickettsiales, neuerdings, d. h. seit 2023: Iodidimonadales) abstammen. Diese Form der Endosymbiose zwischen einem Eukaryoten und einem Bakterium wird als primäre Endosymbiose bezeichnet. Entstand das Zellorganell durch die Aufnahme eines Eukaryoten, der bereits ein primäres Endosymbioseereignis erfahren hat, wird dies als sekundäre Endosymbiose bezeichnet.
Plastiden
Primäre Plastiden
Primäre Plastiden sind von zwei Hüllmembranen umgeben, die den beiden Membranen des aufgenommenen Cyanobakteriums entsprechen, während die bei der Phagocytose entstehende darum herumliegende, ursprüngliche dritte Membran nicht mehr vorhanden ist.[11] Insgesamt gibt es vier Linien von primären Plastiden und somit von autotrophen primären Endosymbionten:[2]
- die Glaucophyten-Linie:
die einzelligen Algen der Glaucophyta (syn. Glaucocystaceae) besitzen Plastiden, die dem Cyanobakterium in vielerlei Hinsicht noch sehr ähnlich sind und daher oft als „Cyanellen“ oder „Cyanoplasten“, gelegentlich auch als „Muroplasten“,[12] bezeichnet werden, - die Rhodophyten-Linie:
Rotalgen (wiss. Rhodophyta) besitzen „Rhodoplasten“ genannte Plastiden, die noch den Antennenaufbau (Phycobilisomen) der Cyanobakterien tragen. - die Chloroplastiden-Linie:
Die Plastiden der Viridiplantae (syn. Chloroplastida, Grünalgen und höhere Pflanzen)[13] stellen die am stärksten entwickelten Plastiden dar und tragen eine große Vielfalt an Antennenkomplexen. Die grünen Plastiden der Algen und höheren Pflanzen werden Chloroplasten genannt. - die Paulinella-Linie:
Die Plastiden der amöboiden Paulinella chromatophora (Euglyphida) nennt man Chromatophoren, manchmal wegen ihres Ursprungs ebenfalls „Cyanellen“.
Bei all diesen Linien wurden die einst aufgenommenen Cyanobakterien so stark angepasst, dass sie frei nicht mehr lebensfähig sind, und zum Organell, dem Plastiden bzw. Chloroplasten wurden. Dies geschah durch ‚endosymbiotischen Gentransfer‘ (EGT, ein Spezialfall des horizontalen Gentransfers HGT) von Genen des Organells auf den Zellkern. Es wurde lange diskutiert, ob so entstandene primäre Chloroplasten aus einem einzigen endosymbiotischen Ereignis oder aus mehreren unabhängigen Ereignissen in verschiedenen eukaryotischen Abstammungslinien stammen. Es wird heute allgemein angenommen, dass praktisch alle Organismen mit primären Chloroplasten einen einzigen gemeinsamen Vorfahren haben, der aus einer primären Endosymbiose vor etwa 600 Millionen bis 2 Milliarden Jahren entstand.[14][15] Das damals aufgenommene Cyanobakterium stand offenbar nahe der heutigen Spezies Gloeomargarita lithophora, diese befindet basal sich im Stammbaum der Cyanobakterien nahe der Gattung Synechococcus.[16][17][18] Die Alge Cyanophora, ein Glaucophyt, gilt als einer der ursprünglichsten Organismen, die einen Chloroplasten enthalten.[19][20]
- Eine Ausnahme ist Paulinella chromatophora. Diese stammt offenbar von einem Vorfahren ab, der unabhängig davon und viel später – vor etwa 90 bis 500 Millionen Jahren – ein Cyanobakterium der Gattung Prochlorococcus (oder Synechococcus) aufgenommen hatte.[15][21][18][22][2]
- Braarudosphaera bigelowii (Ordnung Coccolithophorida) hat das Cyanobakterium Ca. Atelocyanobacterium thalassa[e] UCYN-A als Symbionten in sich aufgenommen, das zur Stickstofffixierung (N2-Fixierung) fähig ist, ein sog. Nitroplast.[23][24][25][26][27][28][29]
- Die Kieselalge Rhopalodia gibba (Familie Rhopalodiaceae)[30] hat neben Kieselalgen-typischen sekundären Plastiden (s. u.) zusätzlich als weitere primäre Endosymbionten Cyanobakterien und reduzierte diese zu sogenannten Sphäroidkörpern (auch Sphaeroide, englisch spheroid bodies), die nicht mehr zur Photosynthese, sondern ebenfalls zur Stickstofffixierung dienen.[31][2][32][33][34] Nach Adler, Trapp et al. (2012)[32] zeigen die Endosymbionten Ähnlichkeit mit den Cyanobakterien-Stämmen ATCC 51142[35][36] und PCC 8801,[37][38] die früher der Gattung Cyanothece zugeordnet wurden, inzwischen aber zu den Spezies Crocosphaera subtropica respektive Rippkaea orientalis (beide Familie Microcystaceae) gehören. Auch die beiden Spezies Rhopalodia gibberula[39] und Epithemia turgida aus derselben Kieselalgen-Gattung bzw. -Familie haben Sphäroidkörper.[40] Wegen der gegenseitigen Abhängigkeit werden diese Sphäroidkörper als Organellen angesehen und daher auch Diazoplaste genannt.[41]
- Der zu den Arbuskulären Mykorrhizapilzen zählende Geosiphon pyriformis enthält endocytobiotische Cyanobakterien der Gattung Nostoc.
Sekundäre Plastiden
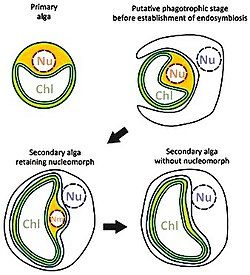
Sekundäre Plastiden verfügen über drei oder sogar vier Hüllmembranen. Es ist kein Fall bekannt, in dem eine Aufnahme eines Glaucophyten zu einer sekundären Endosymbiose geführt hätte. Dagegen existiert eine Fülle von Organismengruppen, die eine Rotalge aufgenommen und sie in unterschiedlichem Maße reduziert haben. Einige Autoren nehmen an, dass dieses Ereignis nur einmal in der Evolution stattgefunden hat, und definieren so das Monophylum der Chromalveolata. In diese Gruppe gehören die Braunalgen, Gelbgrünalgen, Goldalgen, Cryptophyceen, Haptophyceen (Kalkalgen), und die Apicomplexa (z. B. Malaria-Erreger Plasmodium).
Auch sekundäre Endosymbiosen zwischen Eukaryoten und Grün- oder Rotalgen (d. h. primären Endosymbionten) sind bekannt. So wird angenommen, dass die Euglenozoa und die Chlorarachniophyta unabhängig voneinander primäre Endosymbionten in sich aufgenommen haben.
Tertiäre Plastiden
Offenbar ist es auch zu tertiären Endosymbiosen gekommen. Die drei ungewöhnlich pigmentierten Dinoflagellaten-Spezies Gymnodinium galatheanum und Gymnodinium breve und Gyrodinium aureolum (ein Synonym für Gymnodinium aureolum[42]) haben Plastiden, die 19′-Hexanoyloxy-Fucoxanthin als Hauptcarotinoid besitzen und nicht das für die meisten Dinoflagellaten charakteristische Peridinin. Analysen der SSU rDNA aus dem Plastid und dem Kerngenom dieser Dinoflagellaten deuten darauf hin, dass sie ihre Plastiden durch Endosymbiose eines Haptophyten erworben haben. Bei den Haptophyten selbst geht man davon aus, dass ihre Plastiden sekundären Ursprungs sind; daher scheinen diese Dinoflagellaten tertiäre Plastiden zu besitzen.[43]
Mitochondrien und MROs
Es gibt einige Protozoen („Archezoa“), die keine Mitochondrien (und auch keine Plastiden) besitzen. Zunächst wurde angenommen, sie seien primitiv und unmittelbar aus der urtümlichen Wirtszelle der Endosymbionten hervorgegangen. Dies ist vermutlich falsch. Die meisten dieser Organismen besitzen mit den Hydrogenosomen bzw. Mitosomen Organellen, die offenbar entweder von Mitochondrien abstammen oder mit diesen einen gemeinsamen Ursprung in den α-Proteobakterien haben. In einigen Fällen sind sogar noch eigene DNA und Ribosomen vorhanden.[44][45]
Mitochondrien und ähnliche (d. h. abgeleitete) Organellen wie Hydrogenosomen und Mitosomen werden daher zusammen als „mitochondrienverwandte Organellen“ (englisch mitochondrion-related organelles, MROs), auch „mitochondrien-ähnliche Organellen“ (en. mitochondrion-like organelles, MLOs) genannt, klassifiziert. Zu diesen gehören auch die anaeroben und DNA-freien Organellen von Henneguya salminicola (alias H. zschokkei, Myxozoa).[46][47][48][49]
Eine Ausnahme ist die Gattung Monocercomonoides (Excavata), die keine Organellen aus dieser Gruppe aufweist. Man nimmt an, dass diese Einzeller durch horizontalen Gentransfer ein zytosolisches System erworben hatten, um für die Proteinsynthese erforderliche Eisen-Schwefel-Cluster bereitzustellen. Danach waren ihre mitochondrialen Organellen in all ihren Funktionen überflüssig und gingen verloren.[50][51] In all diesen Fällen enthält die DNA im Zellkern Sequenzen, die eindeutig mitochondrialen Ursprungs sind. Wahrscheinlich haben alle amitochondrialen Eukaryoten ihre Mitochondrien sekundär verloren oder umgewandelt.
Eine im Herbst 2020 veröffentlichte Studie legt anhand von umfangreichen Genomanlysen nahe, dass – obwohl bisher noch keine primär amitochondrialen Eukaryoten gefunden wurden – die Vorfahren der Eukaryoten zuerst ihre komplexes Genom mit den zugehörigen Strukturen und danach die Mitochondrien (oder Vorläufer davon) erworben haben.[52]
Weitere MLOs mit eigenem Genom wurden bei Einzellern der Gattung Blastocystis gefunden.[49][53]
Im Jahr 2023 identifizierten Laura Eme, Daniel Tamarit et al. auf Basis einer vergleichenden Analyse von Asgard-Genomen die Ordnung Hodarchaeales innerhalb der Heimdallarchaeia als Schwesterklade der Eukaryoten unter den zu diesem Zeitpunkt bekannten Archaeen.[54]
Geißeln
Lynn Margulis hatte 1970 vermutet, die eukaryotischen Geißeln könnten ihren Ursprung in epibiontischen Spirochaeten haben, die sich symbiotisch an die Ur-Eukaryoten angelagert hätten (Spirochaeten-Hypothese). Zwar gibt es Beispiele für epibiontische Bakterien bei Eukaryoten (siehe Epixenosoma/Euplotidium). Jedoch konnten Hinweise auf DNA in eukaryotischen Basalkörpern bzw. Zentriolen nie bestätigt werden (ganz anders als in Mitochondrien und Chloroplasten). Der Fund, dass Naegleria gruberi beim Übergang vom Amöben- zum begeißelten Flagellaten-Stadium diese Basalkörper bzw. Zentriolen de novo synthetisiert, spricht weiter gegen die Spirochaeten-Hypothese (dies ist von Plastiden und MROs nicht bekannt). Der Ursprung der eukaryotischen Geißeln bleibt aber ungeklärt bzw. in Diskussion. Dabei wurden auch für den Ursprung dieser Organellen und ihrer Mikrotubuli-Struktur andersartige Symbiosen vorgeschlagen.[55][56][57] Andererseits wurden 2022 bei Vertretern der Odinarchaeota Tubulin-Vorstufen gefunden (OdinTubuilin), die Ähnlichkeiten zu prokaryotischen Zellteilungsproteinen (FtsZ) zeigen, was gegen eines symbiotischen Erwerb sprechen könnte.[58]
Indizien

- Man kann heute bei unterschiedlichen Lebewesen verschiedene Stadien zwischen Symbiose und Endosymbiose beobachten:
- Korallen, einige Muscheln, der Wurm Convoluta roscoffensis, aber zum Beispiel auch Blattläuse leben in Symbiose mit Algen oder Bakterien, die im Zellinneren ihrer Wirte leben. Bei den endosymbiotischen Bakterien der Blattläuse werden Beschleunigungen der Evolutionsraten – einhergehend mit Genverlusten und einem Anstieg des AT-Gehaltes der DNA – beobachtet, wie sie auch bei Zellorganellen zu finden sind.
-
- Der Süßwasserpolyp Hydra viridissima (Grüne Hydra) kann durch Endocytose Zoochlorellen aufnehmen und mit deren Hilfe Photosynthese betreiben.
- Manche Acoelomorpha, z. B. die Gattung Waminoa, leben mit Zooxanthellen in Symbiose und ernähren sich unter anderem von deren Photosyntheseprodukten. Symsagittifera roscoffensis (Gattungs-Alias Convoluta, Fam. Convolutidae: Acoela) lebt in Symbiose mit der einzelligen Grünalge Tetraselmis convolutae (die aber auch frei im Ozean leben kann).[59][60]
- Ganz allgemein sind Zooxanthellen Protisten, die als Endosymbionten in einer Reihe von Lebewesen leben können.
- Die Wurzeln einiger Pflanzen leben in Symbiose mit stickstofffixierenden Bakterien (Rhizobien).
- Bei Foraminiferen und Schwämmen kommen Rotalgen als Endosymbionten vor.[59][61]
- Noctiluca scintillans nimmt Grünalgen der Spezies Pedinomonas noctilucae (Pedinophyceae) auf, die im Innern als Endosymbionten weiterleben.[62]
- Bei Dinoflagellaten sind verschiedene Stadien zu finden: Kleptoplastiden, komplexe Rhodoplasten und tertiäre Endosymbiosen, die auf die Aufnahme von Cryptophyceen oder auch Kalkalgen (Haptophyta), eine Gruppe mariner Algen, zurückzuführen sind. Nachgewiesen wurde die tertiäre Endosymbiose zwischen Kalkalgen und Dinoflagellaten bei den Arten Gymnodinium breve, Gymnodinium galatheanum und Gyrodinium aureolum.[63]
- Heterotrophe Dinoflagellaten können auch Symbiosen mit Cyanobakterien bilden. Diese Cyanobionten der Dinoflagellaten werden auch Phaeosomen genannt. Man findet solche Symbiosen am häufigsten in tropischen Meeresumgebungen; die genaue Funktion des Cyanobionten hängt von seiner Wirtsart ab. Häufig vorkommende marine Cyanobakterien der Gattung Synechococcus bilden Symbiosen mit Dinoflagellaten der Gattungen Ornithocercus, Histionesis und Citharistes, von denen man annimmt, dass sie ihrem Wirt durch die Bereitstellung von fixiertem Stickstoff in oligotrophen, subtropischen Gewässern nutzen.[64] Phaeosomen-Symbiosen wurden besonders in geschichteten Umgebungen mit begrenztem Stickstoffangebot dokumentiert; das Leben innerhalb eines Wirts kann für das Cyanobakterium eine für die Stickstofffixierung günstige anaerobe Umgebung bieten.[65] Allerdings gibt es auch widersprüchliche Belege; eine Studie über Phäosomen in Zellen von Ornithocercus spp. hat den Nachweis erbracht, dass Symbionten der Gattung Synechococcus eher organischen Kohlenstoff als Stickstoff liefern, was auf das Fehlen von Nitrogenase in diesen Cyanobakterien zurückgeführt werden könnte.[66]
- Für die 2019 zunächst im meromiktischen Zugersee (Schweiz), dann auch in Seen Frankreichs, Taiwans und Ostafrikas gefundene Gruppe um das Bakterium Candidatus Azoamicus ciliaticola wurde 2021 eine neue Ordnung innerhalb der Gammaproteobacteria mit der provisorischen Bezeichnung eub62A3 group (alias Candidatus Azoamicus group) vorgeschlagen, zusammen mit zwei Untergruppen A (nächst Ca. A. ciliaticola) und B.
Ca. A. ciliaticola lebt endosymbiotisch in Wimpertierchen (Ciliophora) der Klasse Plagiopylea. Das Bakterium kann Nitrat atmen und zur Energieproduktion verwenden, die er seinem Wirt in anaerober Umgebung in den Tiefen des Sees zur Verfügung stellt.[67] - Hatena arenicola beherbergt einen quasi-permanenten, Prasinophyten-ähnlichen Endosymbionten (verwandt mit der Gattung Nephroselmis, Chlorophyta). Bei der Zellteilung bekommt nur eine Tochter den einzelnen Endosymbionten, die andere muss diesen wieder aus der Umwelt erwerben.[2]
- Der Pilz Geosiphon pyriforme (syn. G. pyriformis) enthält endosymbiontische Cyanobakterien der Gattung Nostoc.[68]
- Blattläuse (z. B. die Erbsenlaus) können in besonderen Darmzellen (sog. ‚Bakteriozyten‘) endosymbiontische Bakterien der Gattung Buchnera (ggf. auch Regiella u. a., alle Enterobacteriaceae) beherbergen, die über die Eier an die nächste Generation weitergegeben werden. In den Darmzellen von Motten-Schildläusen (Aleyrodoidea) findet man gleich zwei endosymbiontische Bakterien verschachtelt.[69] Bei Schmierläusen der Spezies Planococcus citri wurde sogar eine verschachtelte ‚sekundäre‘ Endosymbiose gefunden.[70]
- Plastiden und Mitochondrien sind von ihrem Aufbau her Prokaryonten: kein Zellkern, ringförmige DNA, die DNA ist nicht durch Histone assoziiert, sondern durch sogenannte HLPs verdichtet (Analogie), Größe entspricht kleinen Bakterien. Sie stellen ihre eigenen Proteine her, wobei sie einen prokaryotischen Proteinbiosyntheseapparat besitzen. Ihre Ribosomen ähneln denen der Bakterien, nicht denen der Wirtszelle (≤ 70-S- anstatt 80-S-Ribosomen). Die mRNA der beiden Organellen besitzt nicht die für Eukaryoten typische 5'-Cap-Sequenz, und auch die Polyadenylierung fehlt. Die Cyanellen der Glaucophyta sind sogar noch von einer dünnen bakteriellen Zellwand umgeben. Rotalgen und Glaucophyta setzen wie Cyanobakterien Phycobiline zum Auffangen von Photonen in der Photosynthese ein.
- Die DNA-Sequenzen der Mitochondrien ähneln denen der α-Proteobakterien, während Plastiden-DNA-Sequenzen im Cyanobakterien-Stammbaum platziert werden. Ein Vergleich mit der Wirts-DNA weist auf keine Abstammung der Organellen vom Wirt hin.
- Primäre Plastiden und Mitochondrien sind von Doppelmembranen umgeben, wobei, der Hypothese entsprechend, die äußere beim „Verschlucken“ des Bakteriums hinzugekommen ist. Die innere entspricht der von Bakterien (Vorkommen von Cardiolipin, kein Cholesterin; außerdem Vorkommen von Transmembranproteinen (β-barrel-Proteine), die nur in den Membranen von Bakterien und Zellorganellen vorkommen), die äußere der von Eukaryoten.
- Die besten Belege für sekundäre Endosymbiosen finden sich bei den Chlorarachniophyceen, zu den Cercozoa gehörende Amöben, und den Cryptophyceen, einer eigenständigen Algenklasse. Beide Algengruppen enthalten komplexe Plastiden mit vier Hüllmembranen. Zwischen den beiden äußeren und den beiden inneren Hüllmembranen befindet sich der periplastidäre Raum mit einem Nucleomorph, einem stark reduzierten eukaryotischen Zellkern mit je drei linearen kleinen Chromosomen und eukaryotischen 80-S-Ribosomen. Genomsequenzierungen und phylogenetische Analysen zeigten, dass Nucleomorph und Plastid der Chlorarachniophyceen auf eine sekundäre Endosymbiose mit einer Grünalge, der komplexe Plastid der Cryptophyceen jedoch auf eine sekundäre Endosymbiose mit einer Rotalge zurückzuführen sind. Von der Chlorarachniophycee Bigelowiella natans und von der Cryptophycee Guillardia theta wird/wurde das Nucleomorph-Genom vollständig durchsequenziert. Da bei Rotalgen die Stärkesynthese im Cytoplasma stattfindet und nicht wie bei den Grünalgen und Landpflanzen im Plastiden, spricht das Vorkommen von Stärke im periplastidären Raum der Cryptophyceen ebenfalls für eine sekundäre Endosymbiose.
- Mitochondrien und Plastiden vermehren sich durch Teilung und werden bei Teilung der Wirtszelle auf die Tochterzellen verteilt. Sie entstehen nicht de novo, d. h. sie können von der Zelle bei zufälligem Verlust nicht neu gebildet werden.
- Die membrangebundenen ATPasen der Bakterien und Organellen (wie Mitochondrien) sind untereinander nahe verwandt, genauso wie die der Archaeen und die Eukaryoten-eigenen. Zwischen diesen beiden Gruppen besteht nur eine entferntere Verwandtschaft.[71] Bei kleinen Gruppen von Bakterien und Archaeen mit den ‚falschen‘ ATPasen vermutet man horizontalen Gentransfer.[72]
Siehe auch
- Chemische Evolution
- Evolutionstheorie
- Kompartimentierungshypothese
- Ektosymbiose, insbes. mikrobielle E.
- Symbiogenese
- Zooxanthelle
- Kappa-Organismen
Literatur
- A. F. W. Schimper: Über die Entwicklung der Chlorophyllkörner und Farbkörper. In: Bot. Z. Band 41, 1883, S. 102–113.
- C. Mereschkowsky: Über Natur und Ursprung der Chromatophoren im Pflanzenreiche. In: Biologisches Centralblatt. Band 25, 1905, S. 593–604.
- Lynn Margulis, Dorion Sagan: Leben: Vom Ursprung zur Vielfalt. Spektrum Akademischer Verlag, Heidelberg / Berlin 1997, ISBN 3-8274-0524-6 (Übersetzung der englischsprachigen Originalausgabe von 1995).
- Lynn Margulis: Die andere Evolution. Spektrum Akademischer Verlag, Heidelberg / Berlin 1999, ISBN 3-8274-0294-8 (Übersetzung der englischsprachigen Originalausgabe von 1998).
- J. M. Archibald, M. B. Rogers, M. Toop, K-i. Ishida, P. J. Keeling: Lateral gene transfer and the evolution of plastid-targeted proteins in the secondary plastid-containing alga Bigelowiella natans. In: Proceedings of the National Academy of Sciences of the USA. Band 100, 2003, S. 7678–7683.
- S. E. Douglas, S. Zauner, M. Fraunholz, M. Beaton, S. Penny, L. T. Deng, X. Wu, M. Reith, T. Cavalier-Smith, U.-G. Maier: The highly reduced genome of an enslaved algal nucleus. In: Nature. (London). Band 410, 2001, S. 1040–1041.
- Karl-Heinz Linne von Berg, Michael Melkonian u. a.: Der Kosmos-Algenführer. Die wichtigsten Süßwasseralgen im Mikroskop. Kosmos, Stuttgart 2004, ISBN 3-440-09719-6.
- G. I. McFadden: Primary and secondary endosymbiosis and the origin of plastids. In: Journal of Phycology. Band 37, 2001, S. 951–959.
- S. B. Gould, R. F. Waller, G. I. McFadden: Plastid Evolution. In: Annual Review of Plant Biology. Band 59, 2008, S. 491–517.
- N. A. Moran: Accelerated evolution and Muller's ratchet in endosymbiotic bacteria. In: Proceedings of the National Academy of Sciences of the USA. Band 93, 1996, S. 2873–2878.
- S. Turner, K. M. Pryer, V. P. W. Miao, J. D. Palmer: Investigating deep phylogenetic relationships among Cyanobacteria and plastids by small subunit rRNA sequence analysis. In: Journal of Eukaryotic Microbiology. Band 46, 1999, S. 327–338.
- Shinichiro Maruyama, Eunsoo Kim: A Modern Descendant of Early Green Algal Phagotrophs. In: Current Biology. 23, 2013, S. 1081–1084, doi:10.1016/j.cub.2013.04.063.
- William F. Martin, Sriram Garg, Verena Zimorski: Endosymbiotic theories for eukaryote origin. In: Philosophical Transactions of the Royal Society of London B: Biological Sciences. Band 370, Nr. 1678, 31. August 2015, doi:10.1098/rstb.2014.0330 (englisch).
- Wilfried Probst: Frühe Evolution und Symbiose, Europa-Universität Flensburg, Institut für Biologie und Sachunterricht und ihre Didaktik, abgerufen am 19. April 2019
- Przemysław Gagat, Paweł Mackiewicz: Cymbomonas tetramitiformis - a peculiar prasinophyte with a taste for bacteria sheds light on plastid evolution, in: Symbiosis, 10. November 2016, doi:10.1007/s13199-016-0464-1
- Lenka Horváthová et al.: Analysis of diverse eukaryotes suggests the existence of an ancestral mitochondrial apparatus derived from the bacterial type II secretion system. In: Nature Communications, Band 12, Nr. 2947, 19. Mai 2021; doi:10.1038/s41467-021-2304. Siehe Sec-System und Bakterielle Proteinsekretion §Typ II.
- Timothy G. Stephens, Arwa Gabr, Victoria Calatrava, Arthur R. Grossman, Debashish Bhattacharya: Why is primary endosymbiosis so rare? In: New Phytologist, Band 231, Nr. 5, September 2021, S. 1693-1699; doi: 10.1111/nph.17478, PMC 8711089 (freier Volltext), PMID 34018613, Epub: 21. Juni 2021 (englisch).
Weblinks
- M. Neukamm, A. Beyer: Die Grundlagen der Endosymbiontentheorie: Zur Evolution moderner Zell-Organellen. 2011/2022. (PDF; 1,2 MB)
- Energiesparen dank Untermieter. Auf: wissenschaft.de vom 14. Oktober 2005, abgerufen am 8. September 2019
- FR Biologie Hannover: Die Endosymbiontentheorie inklusive einer Erklärung zur Hydrogenhypothese als Alternative zur Endosymbiontentheorie.
- Die Endosymbiontentheorie, Max-Planck-Institut für molekulare Pflanzenphysiologie. Memento im Webarchiv vom 15. Mai 2011. Den dortigen Link zu Hatena findet man jetzt unter:
Christina Schallenberg: Energiesparen dank Untermieter. Auf wissenschaft.de vom 14. Oktober 2005 - Martin Vieweg: Innerer Kompass: Dem „sechsten Sinn“ auf der Spur. Auf wissenschaft.de vom 18. Januar 2022 (Endosymbiotischer Ursprung der Magnetosomen?)
Einzelnachweise
- ↑ Andreas Franz Wilhelm Schimper: Über die Entwicklung der Chlorophyllkörner und Farbkörper. In: Botanische Zeitung. Band 41, Nr. 7, 1883, S. 105–114, 121–131, 137–146, 153–162 (archive.org). (via WebArchiv)
- 1 2 3 4 5 Sven B. Gould, Ross F. Waller, Geoffrey I. McFadden: Plastid Evolution. In: Annual Review of Plant Biology, Band 59, 2008, S. 491–517; doi:10.1146/annurev.arplant.59.032607.092915 (englisch). Siehe insbes. Fig. 1.
- ↑ Konstantin S. Mereschkowski: Über Natur und Ursprung der Chromatophoren im Pflanzenreiche. In: Biologisches Centralblatt. Band 25, 15. September 1905, S. 593–604 (archive.org). (via WebArchiv). (englisch); (en., alternativ)
- ↑ Ivan E. Wallin: On the nature of mitochondria. I. Observations on mitochondria staining methods applied to bacteria. II. Reactions of bacteria to chemical treatment. In: American Journal of Anatomy. 30. Jahrgang, Nr. 2, 1922, S. 203–229, doi:10.1002/aja.1000300203 (englisch).
- ↑ Ivan E. Wallin: On the nature of mitochondria. III. The demonstration of mitochondria by bacteriological methods. IV. A comparative study of the morphogenesis of root-nodule bacteria and chloroplasts. In: American Journal of Anatomy. 30. Jahrgang, Nr. 4, 1922, S. 451–471, doi:10.1002/aja.1000300404 (englisch).
- ↑ Lynn Sagan: On the origin of mitosing cells. In: J. Theoretical Biology. Band 14, Nr. 3, 1967, S. 255–274; doi:10.1016/0022-5193(67)90079-3, PMID 11541392.
- ↑ Bernhard Kegel: Die Herrscher der Welt: Wie Mikroben unser Leben bestimmen. DuMont Köln, Dezember 2015, ISBN 978-3-8321-9773-5.
- ↑ John M. Archibald: Endosymbiosis and Eukaryotic Cell Evolution. In: Current Biology. Band 25, Oktober 2015, S. 911–921.
- ↑ Antonio Lazcano, Juli Peretó: Prokaryotic symbiotic consortia and the origin of nucleated cells: A critical review of Lynn Margulis hypothesis. In: Biosystems. Band 204, Juni 2021.
- ↑ Antonio Lazcano, Juli Peretó: On the origin of mitosing cells: A historical appraisal of Lynn Margulis endosymbiotic theory. In: Journal of Theoretical Biology. Band 434, Dezember 2017, S. 80–87.
- ↑ Thomas Cavalier-Smith: Membrane heredity and early chloroplast evolution. In: trends in plant science. Band 5, Nr. 4, 2000, S. 174–182 (englisch).
- ↑ J. Kenneth Hoober: The structure and function of plastids. Hrsg.: Robert R. Wise. Springer, Dordrecht 2006, ISBN 1-4020-4061-X, S. 3–21 (Online).
- ↑ genauer: Chlorophyta und Streptophyta/Charophyta, letztere mit den Landpflanzen, wissenschaftlich Embryophyta
- ↑ Geoffrey I. McFadden, Giel G. Van Dooren: Evolution: Red Algal Genome Affirms a Common Origin of All Plastids. In: Current Biology. 14. Jahrgang, Nr. 13, 2004, S. R514–6, doi:10.1016/j.cub.2004.06.041, PMID 15242632 (englisch).
- 1 2 Patricia Sánchez-Baracaldo, John A. Raven, Davide Pisani, Andrew H. Knoll: Early photosynthetic eukaryotes inhabited low-salinity habitats. In: Proceedings of the National Academy of Sciences. 114. Jahrgang, Nr. 37, 12. September 2017, S. E7737–E7745, doi:10.1073/pnas.1620089114 (englisch, pnas.org).
- ↑ Rafael I. Ponce-Toledo, Philippe Deschamps, Purificación López-García, Yvan Zivanovic, Karim Benzerara, David Moreira: An Early-Branching Freshwater Cyanobacterium at the Origin of Plastids. In: Current Biology. 27. Jahrgang, Nr. 3, 2017, S. 386–391, doi:10.1016/j.cub.2016.11.056 (englisch).
- ↑ Jan de Vries, John M. Archibald: Endosymbiosis: Did Plastids Evolve from a Freshwater Cyanobacterium? In: Current Biology. 27. Jahrgang, Nr. 3, 2017, S. R103–R105, doi:10.1016/j.cub.2016.12.006 (englisch).
- 1 2 Purificación López-García, Laura Eme, David Moreira: Symbiosis in eukaryotic evolution. In: Journal of Theoretical Biology. 434. Jahrgang, 2017, S. 20–33, doi:10.1016/j.jtbi.2017.02.031 (englisch, elsevier.com).
- ↑ Geoffrey I. McFadden: Chloroplast Origin and Integration. In: Plant Physiology. 125. Jahrgang, Nr. 1, 2001, S. 50–3, doi:10.1104/pp.125.1.50, PMID 11154294, PMC 1539323 (freier Volltext) – (englisch).
- ↑ M. T. Clegg, B. S. Gaut, G. H. Learn Jr, B. R. Morton: Rates and Patterns of Chloroplast DNA Evolution. In: Proceedings of the National Academy of Sciences. 91. Jahrgang, Nr. 15, 1994, S. 6795–6801, doi:10.1073/pnas.91.15.6795, PMID 8041699, PMC 44285 (freier Volltext), bibcode:1994PNAS...91.6795C (englisch).
- ↑ Luis Delaye, Cecilio Valadez-Cano, Bernardo Pérez-Zamorano: How Really Ancient Is Paulinella Chromatophora? In: PLoS Currents. 2016 (englisch, 10.1371/currents.tol.e68a099364bb1a1e129a17b4e06b0c6b).
- ↑ Wilfried Probst: Frühe Evolution und Symbiose, Europa-Universität Flensburg, Institut für Biologie und Sachunterricht und ihre Didaktik: §Auf dem Weg zur Chloroplastenbildung, abgerufen am 19. April 2019.
- ↑ Anne W. Thompson, Rachel A. Foster, Andreas Krupke, Brandon J. Carter, Niculina Musat, Daniel Vaulot, Marcel M. M. Kuypers, Jonathan P. Zehr: Unicellular cyanobacterium symbiotic with a single-celled eukaryotic alga. In: Science, Band 337, Nr. 6101, 21. September 2012, S. 1546–1550; doi:10.1126/science.1222700, PMID 22997339, JSTOR:23269286, ResearchGate: 230895736 (englisch). Siehe insbes. Fig. 2A
(Braarudosphaera ist teilw. als Braarudospheara verschrieben).
Dazu:- Andy Coghlan: Zoologger: The cyanobacteria destined to be organelles. Auf: New Scientist vom 20. September 2012.
- NCBI Nucleotide: Uncultured Chrysochromulina clone Biosope_T60.034 18S, …. Accession: FJ537341.
- ↑ Kyoko Hagino, Ryo Onuma, Masanobu Kawachi, Takeo Horiguchi: Discovery of an Endosymbiotic Nitrogen-Fixing Cyanobacterium UCYN-A in Braarudosphaera bigelowii (Prymnesiophyceae). In: PLOS ONE, 4. Dezember 2013; doi:10.1371/journal.pone.0081749 (englisch).
- ↑ Francisco M. Cornejo-Castillo, Keisuke Inomura, Jonathan P. Zehr, Michael J. Follows: Metabolic trade-offs constrain the cell size ratio in a nitrogen-fixing symbiosis. In: Cell, Band 187, Nr. 7, 11./28. März 2024, S. 1762-1768.e9; doi:10.1016/j.cell.2024.02.016 (englisch). Dazu:
- Jess Cockerill: A Rare Event Gave This Algae an Organelle That Traps And Uses Nitrogen. Auf: sciencealert vom 16. April 2024.
- Evolution in Action? Nitrogen-Fixing Organelles M ay Be Nature’s Next Big Leap. Auf: SciTechDaily vom 16. April 2024.
- ↑ Tyler H. Coale, Valentina Loconte, Kendra A. Turk-Kubo, Bieke Vanslembrouck, Wing Kwan Esther Mak, Shunyan Cheung, Axel Ekman, Jian-Hua Chen, Kyoko Hagino, Yoshihito Takano, Tomohiro Nishimura, Masao Adachi, Mark Le Gros, Carolyn Larabell, Jonathan P. Zehr: Nitrogen-fixing organelle in a marine alga. In: Science, Band 384, Nr. 6692, 11. April 2024; doi:10.1126/science.adk1075 (englisch). Dazu:
- Lars Fischer: Alge macht ungewöhnlichen Evolutionssprung. Auf: spektrum.de von 16. April 2024,
- Elena Bernard: Neu entdecktes Organell fixiert Stickstoff. Auf: wissenschaft.de vom 12. April 2024
(Braarudosphaera ist teilw. als Braarudospharea verschrieben), - Claudia Krapp: Erster Organismus mit Stickstoff-Organell – Wie Nitroplasten Meeresalgen mit Stickstoff versorgen. Auf: scinexx.de vom 15. April 2024
(Braarudosphaera ist teilw. als Braarudospharea verschrieben), - Scientists discover first nitrogen-fixing organelle auf EurekAlert! vom 11. April 2024. Quelle: University of California, Santa Cruz,
- Michael Le Page: A bacterium has evolved into a new cellular structure inside algae. Auf: New Scientist vom 11. April 2024,
- A Decades-Long Mystery – Discovery of “Nitroplast” Challenges Modern Textbooks. Auf: SciTechDaily vom 27. April 2024.
- ↑ NCBI Taxonomy Browser: Braarudosphaera bigelowii (Gran & Braarud) Deflandre 1947 (species).
- ↑ LPSN: Species "Candidatus Atelocyanobacterium thalassae" corrig. Thompson et al. 2012 Synonyms: "Candidatus Atelocyanobacterium thalassa" Thompson et al. 2012 (species).
- ↑ NCBI Taxonomy Browser: Candidatus Atelocyanobacterium thalassa, Details: "Candidatus Atelocyanobacterium thalassa" Thompson et al. 2012, vernacular name: UCYN group A; cyanobacterium UCYN-A (species).
- ↑ NCBI Taxonomy Browser: Rhopalodia gibba, Details: Rhopalodia gibba (Ehrenberg) Otto Mueller 1895 (species).
- ↑ Lothar Geitler: Zur Entwicklungsgeschichte der Epithemiaceen Epithemia, Rhopalodia und Denticula (Diatomophyceae) und ihre vermutlich symbiontischen Sphaeroidkoerper. In: Plant Syst. Evol. Band 128, 1977, S. 259–275; JSTOR:23642226.
- 1 2 Susann Adler, Uwe G. Maier, Eike M. Trapp, Stefan Zauner: Rhopalodia gibba and its endosymbionts as a model for early steps in a cyanobacterial primary endosymbiosis. In: International Society of Endocytobiology: Journal of Endocytobiosis and Cell Research, Band 23, 2012, S. 21-24; Universität Jena: 00270410 (englisch).
- ↑ Susann Adler, Eike M. Trapp, Christine Dede, Uwe G. Maier, Stefan Zauner: Rhopalodia gibba: The First Steps in the Birth of a Novel Organelle? In: W. Löffelhardt (Hrsg.): Endosymbiosis, Springer, Wien 2014, 11. Oktober 2013, S. 167–179; doi:10.1007/978-3-7091-1303-5_9 (englisch).
- ↑ Wilfried Probst: Frühe Evolution und Symbiose, 16. Dezember 2017.
- ↑ LPSN: Species Crocosphaera subtropica Mareš and Johansen 2019; Type strain: ATCC 51142; CBFS A-78-1.
- ↑ NCBI Taxonomy Browser: Crocosphaera subtropica ATCC 51142, equivalent: Cyanothece sp. ATCC 51142.
- ↑ LPSN: Species Rippkaea orientalis Johansen and Mareš 2019; Type strain: CBFS A-17-1; PCC 8801.
- ↑ NCBI Taxonomy Browser: Rippkaea orientalis PCC 8801, heterotypic synonym: Cyanothece sp. PCC 8801.
- ↑ NCBI Taxonomy Browser: Rhopalodia gibberula (Ehrenberg) Otto Mueller [1895] (species).
- ↑ Takuro Nakayama, Yuji Inagaki: Genomic divergence within nonphotosynthetic cyanobacterial endosymbionts in rhopalodiacean diatoms. In: Scientific Reports, Band 7, Nr. 13075, 2. Oktober 2017; doi:10.1038/s41598-017-13578-8 (englisch).
- ↑ Solène L. Y. Moulin, Sarah Frail, Thomas Braukmann, Jon Doenier, Melissa Steele-Ogus, Jane C. Marks, Matthew M. Mills, Ellen Yeh: The endosymbiont of Epithemia clementina is specialized for nitrogen fixation within a photosynthetic eukaryote. In: ISME Communications, Band 4, Nr. 1, 15. April 2024, S. ycae055; doi:10.1093/ismeco/ycae055, PMC 11070190 (freier Volltext), PMID 38707843 (englisch).
- ↑ WoRMS: Gyrodinium aureolum E.M.Hulburt, 1957 – Synonym, Accepted Name: Gymnodinium aureolum (E.M.Hulburt) Gert Hansen, 2000.
- ↑ Torstein Tengs, Ole J. Dahlberg, Kamran Shalchian-Tabrizi, Dag Klaveness, Knut Rudi, Charles F. Delwiche, Kjetill S.Jakobsen: Phylogenetic analyses indicate that the 19'Hexanoyloxy-fucoxanthin-containing dinoflagellates have tertiary plastids of haptophyte origin. In: Molecular Biology and Evolution. Band 17, Nr. 5, 2000, S. 718–729, doi:10.1093/oxfordjournals.molbev.a026350, PMID 10779532 (Online).
- ↑ Brigitte Boxma, Rob M. de Graaf, Georg W. M. van der Staay, Theo A. van Alen, Guenola Ricard, Toni Gabaldon, Angela H. A. M. van Hoek, Seung Yeo Moon-van der Staay, Werner J. H. Koopman, Jaap J. van Hellemond, Aloysius G. M. Tielens, Thorsten Friedrich, Marten Veenhuis, Martijn A. Huynen, Johannes H. P. Hackstein: An anaerobic mitochondrion that produces hydrogen. In: Nature. Band 434, Nr. 7029, 3. Februar 2005, S. 74–79, doi:10.1038/nature03343.
- ↑ A. Akhmanova, F. Voncken, T. van Alen et al: A hydrogenosome with a genome. In: Nature. 396. Jahrgang, Nr. 6711, Dezember 1998, S. 527–528, doi:10.1038/25023, PMID 9859986 (englisch).
- ↑ Jan Osterkamp: Erstes Tier ohne Atmung und Mitochondrien, auf: Spektrum.de vom 25. Februar 2020
- ↑ Tel Aviv University researchers discover unique non-oxygen breathing animal, auf: EurekAlert! vom 25. Februar 2020
- ↑ Siehe auch: H. nuesslini; Pfauen-Lippfisch§Bedrohungen (H. tunisiensis)
- 1 2 Alexandra Stechmann, Karleigh Hamblin, Vicente Pérez-Brocal, Daniel Gaston, Gregory S. Richmond, Mark van der Giezen, C. Graham Clark, Andrew J. Roger: Organelles in Blastocystis that Blur the Distinction between Mitochondria and Hydrogenosomes. In: Current Biology. 18. Jahrgang, Nr. 8, April 2008, S. 580–585, doi:10.1016/j.cub.2008.03.037, PMID 18403202, PMC 2428068 (freier Volltext) – (englisch).
- ↑ Anna Karnkowska, Vojtěch Vacek, Zuzana Zubáčová, Sebastian C. Treitli, Romana Petrželková, Laura Eme, Lukáš Novák, Vojtěch Žárský, Lael D. Barlow, Emily K. Herman, Petr Soukal, Miluše Hroudová, Pavel Doležal, Courtney W. Stairs, Andrew J. Roger, Marek Eliáš, Joel B. Dacks, Čestmír Vlček, Vladimír Hampl: A Eukaryote without a Mitochondrial Organelle. In: Current Biology. 26. Jahrgang, Nr. 10, 2016, ISSN 0960-9822, S. 1274–1284, doi:10.1016/j.cub.2016.03.053, PMID 27185558 (englisch).
- ↑ Davis, Josh L.: Scientists Shocked to Discover Eukaryote With NO Mitochondria. In: IFL Science. 13. Mai 2016, abgerufen am 9. April 2019 (englisch).
- ↑ Julian Vosseberg, Jolien J. E. van Hooff, Marina Marcet-Houben, Anne van Vlimmeren, Leny M. van Wijk, Toni Gabaldón, Berend Snel: Timing the origin of eukaryotic cellular complexity with ancient duplications, in: Nature Ecology & Evolution, 26. Oktober 2020, doi:10.1038/s41559-020-01320-z, dazu:
Timeline Unveiled for One of the Most Important and Puzzling Events in the Evolution of Life, auf: SciTechDaily vom 4. November 2020, Quelle: Institute for Research in Biomedicine (IRB Barcelona) – ‚Bakterien‘ ist hier im Sinn von ‚Prokaryoten‘ zu verstehen. - ↑ A. D. Tsaousis et al.: Anaerobic Parasitic Protozoa: Genomics and Molecular Biology. Caister Academic Press, 2010, ISBN 978-1-904455-61-5, The Blastocystis Mitochondrion-like Organelles, S. 205–219 (englisch).
- ↑ Laura Eme, Daniel Tamarit, Eva F. Cáceres, Courtney W. Stairs, Valerie De Anda, Max E. Schön, Kiley W. Seitz, Nina Dombrowski, William H. Lewis, Felix Homa, Jimmy H. Saw, Jonathan Lombard, Takuro Nunoura, Wen-Jun Li, Zheng-Shuang Hua, Lin-Xing Chen, Jillian F. Banfield, Emily St. John, Anna-Louise Reysenbach, Matthew B. Stott, Andreas Schramm, Kasper U. Kjeldsen, Andreas P. Teske, Brett J. Baker, Thijs J. G. Ettema: Inference and reconstruction of the heimdallarchaeial ancestry of eukaryotes. In: Nature, Band 618, S. 992–999; doi:10.1038/s41586-023-06186-2 (englisch). Dazu:
- Nadja Podbregar: Wir sind alle „Asgardianer“ – Eukaryoten entstanden aus einer Untergruppe der Asgard-Archaeen. Auf: scinexx.de vom 26. Juni 2023.
- Asgard Archaea and All Eukaryotes Share Common Ancestor, Study Says. Auf Sci.News vom 26. Juni 2023.
- ”We’re All Asgardians”: Scientists Discover New Clues About the Origin of Complex Life. Auf: SciTechDaily vom 28. Juli 2023.
- ↑ Jing Yan Li, Chuan Fen Wu: New symbiotic hypothesis on the origin of eukaryotic flagella. In: Naturwissenschaften, Band 92, S. 305–309, 19. Mai 2005; doi:10.1007/s00114-005-0635-z, PMID 15905978.
- ↑ Lillian K. Fritz-Laylin & Chandler Fulton: Naegleria: a classic model for de novo basal body assembly. In: Cilia, Band 5, Nr. 10, 4. April 2016; doi:10.1186/s13630-016-0032-6.
- ↑ Lynn Margulis, Michael F. Dolan, Ricardo Guerrero: The chimeric eukaryote: Origin of the nucleus from the karyomastigont in amitochondriate protists. In: PNAS, Band 97, Nr. 13, 20. Juni 2000, S. 6954-6959; doi:10.1073/pnas.97.13.6954.
- ↑ Caner Akıl, Samson Ali, Linh T. Tran, Jérémie Gaillard, Wenfei Li, Kenichi Hayashida, Mika Hirose, Takayuki Kato, Atsunori Oshima, Kosuke Fujishima, Laurent Blanchoin, Akihiro Narita, Robert C. Robinson: Structure and dynamics of Odinarchaeota tubulin and the implications for eukaryotic microtubule evolution. In: Science Advances, Band 8, Nr. 12, 25. März 2022; doi:10.1126/sciadv.abm2225
. Dazu:
Scientists discover potential key missing link protein bridging eukaryotes and prokaryotes. Auf: EurekAlert! vom 10. April 2022. Quelle: Tokyo Institute of Technology. - 1 2 W. Probst, Europa-Universität Flensburg, §Pflanzentiere und Kleptoplasten
- ↑ Henrike Semmler, Xavier Bailly, Andreas Wanninger: Myogenesis in the basal bilaterian Symsagittifera roscoffensis (Acoela) Myogenesis in the basal bilaterian Symsagittifera roscoffensis (Acoela). In: Frontiers in Zoology. 5. Jahrgang, September 2008, S. 14, doi:10.1186/1742-9994-5-14, PMID 18803837, PMC 2562460 (freier Volltext) – (englisch).
- ↑ W. Reisser (Hrsg.): Algae and Symbiosis: Plants, Animals, Fungi, Viruses, Interactions Explored, Biopress Ltd 1. Mai 1992, Lubrecht & Cramer Ltd 1. Juni 1992, ISBN 0-948737-15-8
- ↑ Aditee Mitra: Meeresbiologie – Das Beste aus zwei Welten, Spektrum der Wissenschaft, April 2019, S. 54–60, hier S. 57
- ↑ Charles F. Delwiche: Tracing the Thread of Plastid Diversity Through the Tapestry of Life. In: The American Naturalist. Vol. 154, Supplement: .Evolutionary Relationships Among Eukaryotes. Okt 1999, S. S164–S177. PMID 10527925. doi:10.1086/303291. (online)
- ↑ N. Gordon, D. L. Angel, A. Neori, N. Kress, B. Kimor: Heterotrophic dinoflagellates with symbiotic cyanobacteria and nitrogen limitation in the Gulf of Aqaba. In: Marine Ecology Progress Series. 107. Jahrgang, 1994, S. 83–88, doi:10.3354/meps107083 (englisch).
- ↑ R. Jyothibabu, N. V. Madhu P. A. Maheswaran, C. R. A. Devi, T. Balasubramanian, K. K. C. Nair, C. T. Achuthankutty: Environmentally-related seasonal variation in symbiotic associations of heterotrophic dinoflagellates with cyanobacteria in the western Bay of Bengal. 1. Januar 2006 (englisch).
- ↑ Sven Janson, Edward J. Carpenter, Birgitta Bergman: Immunolabelling of phycoerythrin, ribulose 1,5-bisphosphate carboxylase/oxygenase and nitrogenase in the unicellular cyanobionts of Ornithocercus spp. (Dinophyceae). In: Phycologia. 34. Jahrgang, Nr. 2, 1. März 1995, S. 171–176, doi:10.2216/i0031-8884-34-2-171.1 (englisch).
- ↑ Jon S. Graf, Sina Schorn, Katharina Kitzinger, Soeren Ahmerkamp, Christian Woehle, Bruno Huettel, Carsten J. Schubert, Marcel M. M. Kuypers, Jana Milucka: Anaerobic endosymbiont generates energy for ciliate host by denitrification. In: Nature, 3. März 2021; doi:10.1038/s41586-021-03297-6 (englisch). Dazu:
- Neue Form der Symbiose entdeckt. Max-Planck-Institut für Marine Mikrobiologie, Pressemitteilung vom 3. März 2021 (deutsch),
- Martin Vieweg: Partnerschaft der besonderen Art: Neue Symbiose-Form entdeckt, auf wissenschaft.de vom 3. März 2021 (deutsch),
- New form of symbiosis discovered. Auf: EurekAlert! vom 3. März 202. (englisch),
- “Unprecedented” New Form of Symbiosis Discovered. Auf: SciTechDaily vom 3. März 2021. Quelle: MPI für Marine Microbiologie (englisch).
- ↑ W. Probst, Europa-Universität Flensburg, §Auf dem Weg zur Chloroplastenbildung
- ↑ W. Probst, Europa-Universität Flensburg, §„Verdauungsendosymbiosen“
- ↑ John P. McCutcheon, Carol D. von Dohlen: An Interdependent Metabolic Patchwork in the Nested Symbiosis of Mealybugs. Current Biology 21 (16), S. 1366-1372, doi:10.1016/j.cub.2011.06.051. PMC 3169327 (freier Volltext). Zitat: „an unnamed Gammaproteobacteria, for which we propose the name Candidatus Moranella endobia, lives inside the Betaproteobacteria Candidatus Tremblaya princeps“: eine sekundäre Endosymbiose also.
- ↑ Nick Lane: Der Funke des Lebens - Energie und Evolution, Konrad Theiss Verlag, (C) 2017 by WBG, ISBN 978-3-8062-3484-8. Englischer Originaltitel: Nick Lane: The Vital Question - Energy, Evolution, and the Origins of Complex Life, Ww Norton, 2015-07-20, ISBN 978-0-393-08881-6, PDF ( des vom 10. September 2017 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.. Textpassagen nahe Abbildung/Figure 10. (Struktur der ATP-Synthase)
- ↑ E. Hilario, J. P. Gogarten: Horizontal transfer of ATPase genes--the tree of life becomes a net of life, in: Biosystems. 1993;31(2-3): S. 111-119. PMID 8155843
License Information of Images on page#
| Image Description | Credit | Artist | License Name | File |
|---|---|---|---|---|
| A diagram showing the course of the establishment of secondary chloroplasts. Schematic view of organelle reduction and membrane heredity through secondary endosymbiosis. The green double membrane, sky-blue membrane and blue membrane represent the inner and the outer chloroplast envelope membranes, periplastidal membrane and chloroplast ER, respectively. The space indicated in yellow is the periplastidal compartment (PPC), which is homogeneous with the cytoplasm in primary endosymbiotic algae. The evolutionary stage of cryptophytes and chlorarachniophytes corresponds to secondary alga that possesses a nucleomorph. | Fig. 1a (contrast enhanced extract) at https://www.nature.com/articles/s41598-017-02668-2 Regulation of chloroplast and nucleomorph replication by the cell cycle in the cryptophyte Guillardia theta . In: Scientific Reports volume 7, Article number: 2345. doi:10.1038/s41598-017-02668-2 | Ryo Onuma, Neha Mishra, Shin-ya Miyagishima | Datei:41598 2017 2668 Fig1a HTML.jpg | |
| Datei:Endosymbiosis.PNG | ||||
| Süßwasserpolyp, grüne Hydra ( Hydra viridissima ) | http://www.mikro-foto.de | Frank Fox | Datei:Mikrofoto.de-Hydra 15.jpg | |
| Piktogramm zum Kennzeichnen von Informationen bei einer Wahl/Abstimmung. | Own illustration, 2007 | Arne Nordmann ( norro ) | Datei:Pictogram voting info.svg | |
| Alternative Darstellung zur Endosymbiontentheorie, bezogen auf autotrophe Organismen. | modified version of Lars Martens' Version (published under public domain; http://de.wikipedia.org/wiki/Bild:Plastiden.jpg ) | Shimon , original Version by Lars Martens | Datei:Plastiden.svg |

