Biomembran
| Übergeordnet |
|---|
| Zelle |
| Untergeordnet |
| Zellmembran Endomembransystem Äußere Membran Doppelmembran |
| Gene Ontology |
| QuickGO |
Eine Biomembran ist eine Trennschicht, die ein Zellkompartiment umgibt oder als Zellmembran den Innenraum einer Zelle vom Außenraum abgrenzt. Innerhalb der Zelle trennen unterschiedlich aufgebaute Biomembranen das Innere von Organellen oder Vakuolen vom Cytoplasma. Eine Biomembran hat durch Membrankomponenten eine aktive Rolle beim selektiven Transport von Molekülen und der Übermittlung von Informationen zwischen den beiden Kompartimenten, zwischen denen sich diese Biomembran befindet.
Permeabilität
Da die Biomembran vor allem eine Trennschicht zwischen verschiedenen Bereichen darstellt, ist sie für die meisten Moleküle undurchlässig. Kleinere lipophile Moleküle können frei durch die Lipiddoppelschicht der Membran diffundieren, wie zum Beispiel Kohlendioxid, Alkohole und Harnstoff. Um die Durchlässigkeit der Membran für lipophobe Teilchen wie Wasser, oder große Teilchen wie Ionen oder Zuckermoleküle zu ermöglichen, sind in die Membran verschiedene Transportproteine eingelagert, die für den Transport bestimmter Stoffe zuständig sind. Deshalb spricht man von selektiver Permeabilität.[1]
Aufbau
Eine Biomembran ist stets topologisch geschlossen und umschließt einen Raum. Nicht in sich geschlossene Membranen kommen in intakten Zellen nicht vor. Biomembranen sind asymmetrisch: sie haben eine dem Cytoplasma zugewandte plasmatische Seite (P-Seite) und eine extraplasmatische Seite (E-Seite).[2]
Biomembranen bestehen aus Lipiden und Proteinen. An die Proteine können Kohlenhydratketten geknüpft sein. Der Lipidanteil bildet als Lipiddoppelschicht die Grundsubstanz der Membran und ist für ihre besonderen physikochemischen Eigenschaften verantwortlich. Insbesondere wirkt diese Doppelschicht als passive Trennschicht. Steroide wie das Cholesterin gehen eine hydrophobe Wechselwirkung mit den Lipiden ein und verfestigen, bei hohen Konzentrationen in der Biomembran, die ansonsten flexible Biomembran. Darüber hinaus sind auf und innerhalb der Membran Proteine verteilt, welche die aktiven Funktionen der Membran übernehmen. Die Proteine haben nur eine sehr geringe Stützfunktion der Biomembran, da sie durch die Lipidschichten schwimmen.
Biomembranen können anhand ihrer Dichte charakterisiert werden; sie liegt meist zwischen 1,12 und 1,22 g·cm−3. Die Dichte ist vom Gewichtsverhältnis der Proteine zu den Lipiden abhängig: je nach Funktion der Membran werden Werte von 0,25 (Myelinmembran, geringer Proteinanteil), 1,3 (Plasmamembran von Erythrozyten), 2,5 (Plasmamembran von E. coli), 2,9 (Innere Mitochondrienmembran) bis hin zu einem Wert von 5 in der Purpurmembran bei Halobacterium (hoher Proteinanteil) gefunden.[3]
In bestimmten Arten von Zellorganellen (Zellkern, Mitochondrium, Plastid) treten Biomembranen als Doppelmembran auf.
Phospholipiddoppelschicht
Die Lipiddoppelschicht besteht größtenteils aus amphiphilen Phospholipiden, die eine hydrophile Kopfgruppe und eine hydrophobe Schwanzgruppe (meistens Kohlenwasserstoffketten) besitzen. In Wasser bildet sich, als eine Folge des hydrophoben Effektes, eine Doppelschicht, bei der die hydrophoben Schwänze nach innen und die hydrophilen Köpfe nach außen zeigen. Wegen des hydrophoben Kerns ist eine solche Lipiddoppelschicht nahezu undurchlässig für Wasser und wasserlösliche Moleküle, gleichzeitig aber sehr flexibel und mechanisch schwer zu zerstören. Aus diesem Grund hinterlässt selbst ein Einstich mit einer Pipette kein Loch in der Membran. Dafür kann sie durch Lipidlösungsmittel und Lipasen zerstört werden.
Membranen sind aus drei Haupttypen von Lipiden aufgebaut: Phosphoglyceride, Sphingolipide und Cholesterin.
Phospholipide
- Phospholipide zeichnen sich durch eine Phosphatgruppe aus, sie machen den Hauptteil der Membranlipide aus. Meistens besitzen sie ein Grundgerüst aus Glycerin, „quer“ zur Membran, daher nennt man sie Phosphoglyceride. Zwei der drei Hydroxygruppen des Glycerins sind mit hydrophoben Fettsäuren verestert, die dritte mit einer hydrophilen Phosphatgruppe. Die Phosphatgruppe kann einen weiteren Substituenten tragen. Tut sie das nicht, was in Membranen fast nicht vorkommt, würde das Molekül Phosphatidsäure genannt. Als Substituent häufig ist Cholin, was zu Phosphatidylcholin (PC) führt, oder aber auch Ethanolamin, führt zu Phosphatidylethanolamin (PE), Serin, führt zu Phosphatidylserin (PS) oder Inositol, führt zu Phosphatidylinositol (PI). Es gilt, dass alle beschriebenen Moleküle aus einer hydrophilen Kopfgruppe bestehen, dem Phosphat mit Substituenten und einem hydrophoben Schwanz, einer unverzweigten Fettsäure aus 16 bis 20 Atomen. Je nach Anzahl der Doppelbindungen in der Fettsäure unterscheidet man gesättigte Fettsäuren (keine Doppelbindungen), einfach ungesättigte (eine Doppelbindung), bis hin zu vielfach ungesättigten.
Sphingolipide
- Ein Sphingolipid ist eine Verbindung aus einem Sphingosin, das über seine Aminogruppe mit einer Fettsäure verknüpft ist. Die Hydroxygruppe kann mit verschiedenen Gruppen verestert sein, ohne Veresterung ergeben sich Ceramide, eine Veresterung mit Phosphocholin ergibt Sphingomyelin und mit Sacchariden ergeben sich Glycosphingolipide. Sphingolipide sind ebenfalls amphipathisch und ähneln darin den Phospholipiden.
Cholesterin
- In tierischen Membranen kann bis zu 50 % Cholesterin enthalten sein ( Masseprozent), weniger bei Pflanzen und bei Bakterien gar nicht. Cholesterin ist klein und wenig amphipathisch, aus diesem Grund befindet sich auch nur die Hydroxygruppe an der Membranoberfläche und der Rest des Moleküls in der Membran. Das starre Ringsystem des Cholesterins behindert den Fluss der Lipidschicht, macht diese also starrer. [4]
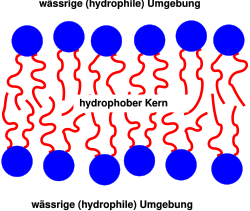
Die Lipiddoppelschicht einer Biomembran ist normalerweise flüssig, d. h. die Lipide und Proteine sind in der Ebene der Membran recht beweglich. Ein Austausch von Lipiden zwischen den beiden Schichten oder gar ein Lösen eines Lipids von der Membran ist jedoch sehr selten. Eine gezielte Bewegung von einer Membranseite zur anderen (Flipflop) ist normalerweise nur unter dem aktiven Mitwirken von speziellen Proteinen (sogenannte Flippasen und Floppasen) unter Verbrauch von Adenosintriphosphat (ATP) möglich. Dabei transportieren Flippasen Lipide von der Außenseite der Plasmamembran zur cytosolischen Seite. Floppasen sind klassische ABC-Transporter und befördern Membranlipide von der cytosolischen Seite der Plasmamembran nach außen. Weitere Transporter für Membranlipide sind Scramblasen, die allerdings nicht ATP-abhängig Membranlipide in Richtung ihres Konzentrationsgradienten austauschen, bis sich ein Gleichgewicht eingestellt hat.
Wie flüssig die Lipiddoppelschicht ist, hängt vor allem von der Anzahl der Doppelbindungen in den hydrophoben Kohlenwasserstoffketten der Lipide ab, einige Bakterien[5] nutzen auch Kettenverzweigungen. Je mehr, desto flüssiger ist die Membran. Andererseits wird der Grad der Flüssigkeit durch andere eingelagerte Moleküle bestimmt. Cholesterin zum Beispiel vermindert einerseits die Fluidität, verhindert aber bei niedrigen Temperaturen, dass sich die Membran gelartig verfestigt.
Vitamin E ist ein Antioxidans (wie Vitamin C), es schützt die ungesättigten Kohlenwasserstoffketten der Phospholipide der Biomembran vor der Zerstörung durch freie Radikale (Lipidperoxidation).
Membranproteine
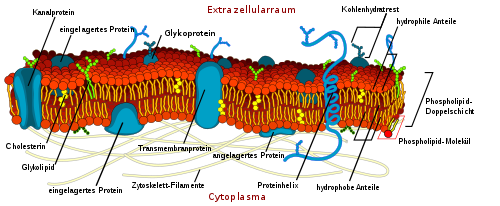
Verschiedene Arten von Membranproteinen, die in die Lipiddoppelschicht eingelagert sind, sorgen über Protein-Lipid-Interaktionen für unterschiedliche Eigenschaften der Biomembranen. Auch die beiden Seiten einer Biomembran können sich durch die Anordnung der Membranproteine stark unterscheiden. Während beispielsweise Rezeptoren für Zell-Zell-Kommunikation und für Detektion von Umweltveränderung nach außen hin gerichtet sind, weisen an Reaktionen beteiligte Enzyme nach innen (sie liegen also im Cytoplasma).
Viele Proteine sind am Membrantransport beteiligt, d. h. am Stoffaustausch und der Signalübertragung über spezifische Rezeptoren. Gut untersucht ist eine Vielzahl von Membranproteinen, die unterschiedliche Zellarten und deren Reifestadien charakterisieren und sich von Individuum zu Individuum unterscheiden können (zum Beispiel Blut- und Gewebegruppen). Dazu gehören auch Moleküle (meist Glykoproteine), die nach dem Schlüssel-Schloss-Prinzip zur Eigen-Fremd-Unterscheidung beitragen.
Nach dem Flüssig-Mosaik-Modell sind die Membranproteine nicht starr in der Membran fixiert, sondern zu hochdynamischen Ortsveränderungen innerhalb der Membran fähig. Diese Dynamik bildet die Voraussetzung für die Auslösung von Signalketten auf Zellebene sowohl intrazellulär als auch zwischen kooperierenden Zellen.
Eine Einteilung der Membranproteine ist nach ihrer Verankerung in der Lipiddoppelschicht möglich:
Integrale Proteine
- Durch Gensequenzierung vermutet man, dass 30 % aller kodierten Proteine integrale Proteine sind. Integrale Proteine durchqueren als Transmembranproteine beide Lagen der Lipiddoppelschicht, manche einfach, andere mit mehreren Schleifen. Dabei ragen Anteile des Proteins aus der Membran heraus. Integrale Proteine sind ebenso wie Phospholipide amphipathisch. Domänen innerhalb der Membran sind hydrophob, der Aminosäurerest wechselwirkt hier mit den Lipidketten. Diese ungerichteten Kräfte allein würden jedoch nicht für eine Stabilisierung ausreichen; bei vielen Proteinen wechselwirkt ein Streifen meist basischer Reste mit den geladenen Kopfgruppen der Phospholipide. Der weitere Anteil, der aus der Membran herausragt, wechselwirkt mit dem umgebenden Wasser und den darin gelösten Stoffen. Integrale Proteine sind nicht unbedingt fest in der Membran verankert, sondern können auch frei beweglich sein.
Periphere Proteine
- Periphere Proteine können sich auf der Innen- und Außenseite der Membran befinden. [6] Sie sind durch eine Mischung aus elektrostatischen und hydrophoben Wechselwirkungen sowie anderen, nichtkovalenten Bindungen an diese oder an integrale Proteine temporär angelagert. Die Anlagerung ist dynamisch, je nach Bedingung können sie gebunden oder gelöst werden. Um sie zu gewinnen, muss die Membran nicht zerstört werden; eine hochkonzentrierte Salzlösung reicht, um sie in Lösung zu bringen, da diese die elektrostatischen Wechselwirkungen schwächt. Als Beispiel am besten untersucht sind auf cytoplasmatischer Seite Proteine, die als Fibrillen so etwas wie ein Skelett bilden, solche, die Beschichtungen bilden und Enzyme. Periphere Proteine außerhalb gehören meist zur extrazellulären Matrix. Integrale und periphere Proteine können posttranslational modifiziert werden durch Bindung an Fettsäurereste, Prenylierung oder einen GPI-Anker.
Lipidverankerte Proteine
- Lipidverankerte Proteine zählen zu den peripheren Proteinen und ragen somit ebenfalls nicht durch die Membran hindurch, sind aber kovalent mit einem in die Membran eingelagerten Lipidmolekül verbunden. Man unterscheidet verschiedene Arten (u. a. Prenylierung ( Farnesylierung, Geranylgeranylierung), S-Acylierung oder Myristoylierung), viele jedoch sind GPI-verankert. Proteine mit einem GPI-Anker befinden sich an der Außenseite der Plasmamembran. [4]
Funktion
Das Zytoplasma im Inneren einer Zelle wird durch eine Biomembran nach außen abgegrenzt. Diese nennt man Zellmembran, Plasmamembran, Plasmalemma oder Membrana cellularis. Biomembranen besitzen die folgenden Aufgaben:
- Kompartimentierung
- Jede Biomembran stellt aus energetischen Gründen eine lückenlose Schicht dar. Bei mehreren Membranen ergeben sich somit automatisch voneinander getrennte Räume, sogenannte Kompartimente. Die meisten Zellen enthalten Reaktions- und Speicherräume ( Kompartimente), wie zum Beispiel die Zellorganellen und Vakuolen mit sehr unterschiedlichen chemischen Eigenschaften. In den unterschiedlichen Kompartimenten befinden sich sehr unterschiedliche Stoffe. Somit sind sehr unterschiedliche, z. T. sogar gegensätzliche Prozesse zur gleichen Zeit möglich, die sich nicht gegenseitig beeinträchtigen, wie Kohlenhydratauf- und -abbau. Des Weiteren wird eine individuelle Regulation möglich.
- Gerüst für biochemische Aktivität
- Für spezifische Reaktionen ist die exakte Ausrichtung der Moleküle gegeneinander notwendig, da bestimmte Wechselwirkungen eingegangen werden müssen. In Lösung ist diese exakte Ausrichtung nicht möglich. Biomembranen bieten nun ein Gerüst, an dem Moleküle effektiv miteinander wechselwirken und reagieren können. Wichtige Reaktionen wären sonst nicht möglich; der Multienzymkomplex der Atmungskette und der Photosynthese sind beispielsweise in der Membran verankert.
- Selektive Permeabilität
- Teilchen durchdringen Membranen nicht ungehindert, sondern können ausgewählt und eventuell zurückgehalten werden.
- Transport gelöster Stoffe
- Moleküle können von der einen Seite der Membran auf die andere Seite transportiert werden, auch gegen ein Konzentrationsgefälle (also aktiv). So können Nährstoffe in der Zelle angereichert werden. Ionen können auch quer zur Membran transportiert werden, dies spielt eine große Rolle für Nerven und Muskeln.
- Reaktion auf externe Signale
- Die Plasmamembran ist wichtig für eine Reaktion auf externe Reize (also für die Signalübertragung). In der Membran liegen Rezeptoren. Diffundiert ein bestimmtes Molekül in ihre Nähe (ein Ligand) können sich beide auf Grund ihrer komplementären Struktur verbinden und der Rezeptor gibt ein Signal an die Zelle ab. Unterschiedliche Rezeptoren erkennen unterschiedliche Liganden, sodass die Zelle so Informationen über ihre Umwelt aufnehmen kann. Reaktionen auf die Umwelt wären durch eine Veränderung der Enzymtätigkeit den Stoffwechsel anzupassen, Speicherstoffe freizusetzen oder sogar Selbstmord zu begehen.
- Interzelluläre Wechselwirkung
- Die Plasmamembran ist die Außenschicht der Zelle. Bei Vielzellern tritt eine Zelle über die Plasmamembran mit ihren Nachbarzellen in Wechselwirkung. So können Zellen z. B. aneinander haften oder Signale und Material austauschen.
- Energieumwandlung
- Membranen wirken mit an Energieumwandlungen wie der Photosynthese und dem Kohlenhydratabbau. Bei Eucaryoten findet ersteres in den Chloroplasten statt, letzteres in den Mitochondrien.
- Oberflächenvergrößerung
- Kleine Ausstülpungen der Biomembran, sogenannte Mikrovilli, vergrößern die Zelloberfläche und so die Fläche an der gearbeitet werden kann, da an der Biomembran besonders intensiv Stoffwechsel stattfindet. [4]
Fluidität
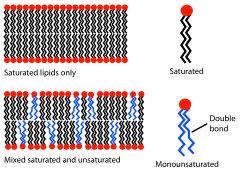
Die Fluidität einer Biomembran hängt von der Temperatur ab. Eine Membran aus Phosphatidylcholin und Phosphatidylethanolamin, deren Fettsäurereste gesättigt sind, wäre bei 37 °C recht fluid. In diesem Zustand könnte man die Membran als zweidimensionalen Flüssigkristall betrachten. Die Längsachsen der Phospholipide richten sich parallel aus, die Phospholipide selbst können sich drehen und in der Ebene frei bewegen. Bis zu einer gewissen Temperatur, der Übergangstemperatur, ist die Bewegung der Phospholipide stark eingeschränkt und die Membraneigenschaften ändern sich, der Zustand ähnelt jetzt eher dem eines gefrorenen Gels. Die Übergangstemperatur hängt von der Art der Lipide ab; je kürzer sie sind und je mehr Doppelbindungen sie enthalten, desto geringer ist sie. Cholesterin stört die gewöhnliche Struktur der Membran und verringert die Mobilität der Membranlipide. Die Übergangstemperatur ist dann nicht mehr eindeutig zu bestimmen. Bei tierischen Zellen sorgt das Lipid Cholesterin, selbst bei Temperaturschwankungen, für einen Beibehalt des Flüssigkeitszustandes.
Bedeutung
Die Fluidität einer Biomembran liegt zwischen starr und flüssig und erlaubt so eine gewisse Struktur. Membranproteine können sich zu funktionalen Einheiten zusammenlagern und später wieder trennen. Dies ist zum Beispiel wichtig für die Photosynthese. Fluidität spielt auch eine große Rolle bei der Membrangenese und ist wichtig für viele grundlegende Prozesse wie Zellteilung, Zellwachstum, Sekretion etc. Während die Temperatur oft schwankt, muss die Membranfluidität dabei konstant bleiben. Um dies zu erreichen, können die Membranlipide modifiziert werden: Möglich ist ein Austausch von Phospholipiden; Desaturasen können aus Einfachbindungen Doppelbindungen bilden, Phosphatrückgrat und Lipidschwänze der Phospholipide können umverteilt werden und es kann ein höherer Anteil an ungesättigte Fettsäuren produziert werden als vorher. So ist speziell wechselwarmen Lebewesen eine Umweltanpassung möglich.
Lipidflöße
In der Biomembran sind Lipidmoleküle nicht gleichmäßig verteilt, sondern es existieren Mikrodomänen mit besonderer Lipidzusammensetzung. Speziell Cholesterin und Sphingolipide neigen zu solch einem Zusammenschluss. Manche Proteine, wie solche mit GPI-Anker, sammeln sich in solchen Bereichen an, während andere dort besonders selten zu finden sind. Vermutlich sind Lipidflöße sehr klein und in einem ständigen Prozess der Auflösung und Neubildung begriffen.
Geschichte
- 1895 Charles Ernest Overton nimmt an, dass die Biomembranen aus Lipiden bestehen. Dieses schloss er aus Beobachtungen, dass lipophile (fettlösliche) Substanzen, zum Beispiel bestimmte Narkosemittel, sehr viel einfacher in Zellen gelangen können als solche Stoffe, die lipophob sind.
- 1917 Irving Langmuir vermutet, dass Phospholipide auf der Wasseroberfläche schwimmen.
- 1925 wurde von den niederländischen Wissenschaftlern Gorter und Grendel das Bilayer-Modell entwickelt:[7] Phospholipide mit hydrophilen Gruppen sind als Doppelschicht in der Membran so angeordnet, dass die hydrophilen Gruppen der Lipide jeweils nach außen zeigen, die hydrophoben in das Innere der Doppelschicht. Allerdings ließen die beiden Forscher mit ihrem Modell den großen Proteinanteil der Biomembran völlig außer Acht.
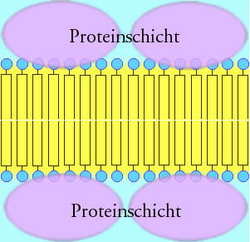
- 1935 stellten J. F. Danielli und H. Davson das klassische Modell des Aufbaus einer Biomembran vor: Die Biomembran besteht aus einer bimolekularen Lipidschicht. Die hydrophoben Schwänze der Lipide stehen sich gegenüber, die hydrophilen Köpfe sind von Proteinen überzogen. Kurz: Protein – Lipiddoppelschicht – Protein (Sandwich-Struktur). Elektronenmikroskopische Aufnahmen von Biomembranen lassen einen dreischichtigen Aufbau erkennen: zwei äußere Schichten (je 2,5 nm dick) und eine mittlere Schicht (3 nm dick). Dieses Membranmodell wird als Einheitsmembran (engl.: unit membrane) bezeichnet.
- 1972 entwickelten Seymour Jonathan Singer und G. L. Nicolson das Flüssig-Mosaik-Modell (fluid mosaic model) einer Biomembran:[8] Globuläre Proteinmoleküle „schwimmen“ in einem bimolekularen Lipidfilm. Der Lipidfilm verhält sich wie eine zähe zweidimensionale Flüssigkeit, dadurch können Lipidmoleküle und Proteine ungehindert in der Membranebene diffundieren. Es gibt zwei Typen der Membranassoziation von Proteinen. Integrale Proteine, auch transmembrane Proteine genannt, reichen durch die Membran hindurch. Periphere Proteine, auch assoziierte Proteine genannt, sind der Lipid-Doppelschicht aufgelagert.
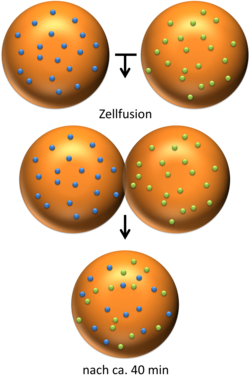
- 1972: Zur gleichen Zeit wie Singer und Nicolson schlossen Frye und Edidin aus Versuchen mit zwei Zellen, bei denen bestimmte Membranproteine markiert wurden, dass die Membran nicht statisch sein kann, sondern in ständiger Bewegung ist. Sie vereinigten die markierten Zellen und die erst getrennt vorliegenden markierten Bereiche der Membran vermischten sich.
- 1983 stellten Mouritsen und Bloom das Mattress-Modell der Zellmembran vor. Es besagt, dass der in die Membran eingebettete hydrophobe Teil der Membranproteine nicht stets genau die entsprechende Größe der Zellmembran hat und sich somit Lipide verschiedener Kettenlänge passend um bestimmte Membranproteine lagern.[9]
- Seit der Aufstellung des Flüssig-Mosaik-Modells von Singer und Nicholson 1972 wurden zahlreiche Hinweise entdeckt, die zur Formulierung des dynamisch strukturierten Mosaikmodelles[10] führten. Verschiedene Untersuchungen zeigten, dass die Proteine und verschiedenen Lipidmoleküle keineswegs gleichmäßig auf der Oberfläche der Membran verteilt sind, wie es in einer reinen Flüssigkeit zu erwarten wäre. Stattdessen scheint es Gebiete mit einer hohen Konzentration von bestimmten Proteinen (sogenannte Rezeptor-Inseln) oder bestimmten Lipidtypen zu geben (sogenannte Lipid Rafts), die sich ständig umgruppieren, auflösen und wieder zusammenfinden.
Inneres Membransystem
Das innere Membransystem umfasst verschiedene Zellkomparimente oder Organellen in eukaryotischen Zellen, welche von Biomembranen umgeben sind. Dazu gehören: die Kernmembran, das endoplasmatische Retikulum, der Golgi-Apparat, Lysosomen, Vesikel, Endosomen und die Plasmamembran. Die meisten Proteine, die für Organellen des inneren Membransystems vorgesehen sind, werden cotranslational ins endoplasmatische Retikulum transportiert und von dort über den sekretorischen Weg im inneren Membransystem transportiert.
Weblinks
- Biomembranen / Plasmamembran und Glykokalix / Flüssig-Mosaik-Modell Grafik
- Phillip Eichman: From the lipid bilayer to the fluid mosaic: a brief history of membrane models. SHiPS Resource Center: Sociology, History and Philosophy of Science: teachers’ network news. Vol. 9 (2), 1999.
Einzelnachweise
- ↑ Biomembrane I: Selective Permeability of Membranes. ( vom 8. Februar 2008 im Internet Archive)
- ↑ H. Kleinig, P. Sitte: Zellbiologie. 2. Auflage. Stuttgart 1986, ISBN 3-437-30528-X, S. 33.
- ↑ Hans Kleinig, Uwe Maier: Kleinig/Sitte Zellbiologie. Verlag Gustav Fischer, 1999, ISBN 3-437-26010-3.
- 1 2 3 Gerald Karp, Kurt Beginnen: Molekulare Zellbiologie. Springer, 2005, ISBN 3-540-27466-9, S. 157–230.
- ↑ T. Kaneda: Iso- and anteiso-fatty acids in bacteria: biosynthesis, function, and taxonomic significance. In: Microbiol. Rev. 55(2), June 1991, S. 288–302. PMID 1886522
- ↑ S. Tan, H.T. Tan, M.C. Chung: Membrane proteins and membrane proteomics. In: Proteomics. Band 8, Nr. 19, Oktober 2008, S. 3924–3932, doi:10.1002/pmic.200800597, PMID 18763712.
- ↑ E. Gorter, F. Grendel: On bimolecular layers of lipoids on the chromocytes of the blood. In: Journal of Experimental Medicine. Band 41, 1925, S. 439–443.
- ↑ S. J. Singer, G. L. Nicolson: The fluid mosaic model of the structure of cell membranes. In: Science. Band 175, 1972, S. 720–731. PMID 4333397.
- ↑ O. G. Mouritsen, M. Bloom: Mattress model of lipid-protein interactions in membranes. In: Biophys. J. Band 46, Nr. 2, August 1984, S. 141–153, doi:10.1016/S0006-3495(84)84007-2, PMID 6478029, PMC 1435039 (freier Volltext).
- ↑ G. Vereb u. a.: Dynamic, yet structured: The cell membrane three decades after the Singer-Nicolson model. In: Proc. Natl. Acad. Sci. USA. Band 100, 2003, S. 8053–8058. PMID 12832616, PMC 166180 (freier Volltext).
License Information of Images on page#
| Image Description | Credit | Artist | License Name | File |
|---|---|---|---|---|
| Detailierte Darstellung der Zellmembran, mit integralen Proteinen, Matrix und bilayer Aufbau. | Translation of File:Cell membrane detailed diagram en.svg . Image renamed from File:Cell membrane detailed diagram german.svg | LadyofHats , translation Muffco | Datei:Cell membrane detailed diagram de.svg | |
| Sketch of a fluid lipid bilayer | Eigenes Werk | Olaf Lenz | Datei:Lipid bilayer fluid.svg | |
| A schematic diagram showing how unsaturated lipids disturb the packing order of a lipid bilayer and result in a more open fluid structure | Eigenes Werk | MDougM | Datei:Lipid unsaturation effect.svg | |
| Lipid-Doppelschicht sandwich-modell; selbst erstellt; gemeinfrei | Übertragen aus de.wikipedia nach Commons mithilfe des CommonsHelper . | Hati in der Wikipedia auf Deutsch | Datei:Membran2.png | |
| Schema des Versuchs von Frye und Edidin 1972: die Membranproteine zweier Zellen werden unterschiedlich farbig markiert, anschliessend werden die beiden Zellen fusioniert, nach ca. 40 Minuten haben sich die Membranproteine auf der neuen Zelle gleichmässig verteilt; sie müssen sich also in der Membran bewegen können (→ Fluid-Mosaic-Modell) | Eigenes Werk, basierend auf: NATURA – Biologie für Gymnasien , Klett-Verlag | Römert | Datei:Versuch zum Fluid-Mosaic-Modell.png |

