Ionische Bindung
Die ionische Bindung (auch Ionenbindung, heteropolare Bindung oder elektrovalente Bindung) ist eine chemische Bindung, die auf der elektrostatischen Anziehung positiv und negativ geladener Ionen basiert und als solche insbesondere für Salze charakteristisch ist.
Eine reine ionische Bindung, bei welcher ein Atom oder Molekül ein Elektron vollständig an ein anderes übergibt, kommt nicht vor. Ionische Bindung tritt immer zusammen mit kovalenter Bindung auf, bei der die Elektronen zwischen den Atomen geteilt werden. Von ionischer Bindung spricht man, wenn deren Anteil gegenüber der kovalenten Bindung überwiegt.
Beschreibung
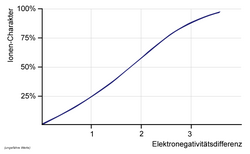
Die Ionenbindung wurde um 1916 von Walther Kossel formuliert. Ab einer Elektronegativitäts-Differenz von ΔEN = 1,7 spricht man von einem 50 % partiell ionischen Charakter.[1] Bei einer Differenz größer als 1,7 liegen demnach ionische Bindungen vor. Damit gibt es eine Ionenbindung, die komplett aus Halogenen besteht; diese Ionenbindung ist Astatfluorid (At+F−) (ΔEN = 1,78) . Unter diesem Wert liegen polare, also überwiegend kovalente, Bindungen vor. Dies sind jedoch relativ willkürlich gesetzte Grenzen, da der Fall der reinen ionischen Bindung eine Idealisierung darstellt.
Als grober Anhaltspunkt kann gelten, dass eine Ionenbindung zwischen Elementen zustande kommt, die links im Periodensystem (PSE) stehen, und Elementen, die rechts im PSE stehen. Schaut man sich den Ionenbindungsanteil zum Beispiel von Natriumchlorid an, welches oft als klassischer Fall der Ionenbindung angesehen wird, so stellt man einen Wert von etwa 75 Prozent fest. Ein anderes Beispiel wäre Caesiumfluorid mit etwa 92 Prozent. Ionenbindungen haben also in allen Fällen auch einen Anteil an kovalenter Bindung. Umgekehrt gilt dies nicht, denn innerhalb sogenannter Elementmoleküle existiert die 100-prozentige kovalente Bindung.
Die Bindung entsteht durch die elektrostatische Anziehung entgegengesetzt geladener Teilchen. Die Ionen sind regelmäßig in einem Ionengitter angeordnet und sie bilden häufig Kristalle. Ihr Aufbau ist abhängig von der Ladung und den Größenverhältnissen der Ionen. Ionenbindungen haben hohe Schmelz- und Siedepunkte. Die starken Anziehungskräfte zwischen den Teilchen können durch Lösungsmittel, z. B. Wasser, überwunden werden. Feste (kristalline) Ionenverbindungen leiten keinen elektrischen Strom. Im gelösten oder geschmolzenen Zustand leiten sie elektrischen Strom, weil sich dann die elektrisch geladenen Teilchen frei bewegen können.
Elektronenkonfiguration

Die Atome streben durch Aufnahme oder Abgabe von Elektronen danach, für ihre äußerste besetzte Schale die Edelgaskonfiguration und den energieärmsten Zustand zu erreichen. Dies wird entweder durch Elektronenabgabe seitens der Elemente mit geringerer Elektronegativität erreicht (links im PSE), dabei entstehen einfach oder auch mehrfach positiv geladene Kationen. Im anderen Fall entstehen durch Elektronenaufnahme seitens der Elemente mit höherer Elektronegativität und dadurch hoher Elektronenaffinität (im PSE rechts stehende Elemente), einfach oder mehrfach negativ geladene Anionen.
Bildung des Ionengitters
Die Kationen und Anionen ziehen sich elektrostatisch an; die bei der Vereinigung der beiden Ionenarten freiwerdende Energie wird als Gitterenergie bezeichnet und ist die eigentliche Triebkraft der Salzbildung. Die Gitterenergie setzt sich dabei aus insgesamt 4 Komponenten zusammen:
- der Nullpunktenergie der Ionen,
- den Abstoßungsenergien zwischen den Kernen einerseits und zwischen den Elektronenhüllen andererseits,
- der Bindungsenergie, die aus London-Kräften zwischen mehr oder weniger gut polarisierbaren Elektronenhüllen oder aus Multipol-Wechselwirkungen (bei Ionen mit unsymmetrischer Ladungsverteilung wie NO2) resultiert und
- schließlich der coulombschen Kraft zwischen den entgegengesetzt geladenen Ionen.
Die Gitterenergie lässt sich empirisch mit dem Born-Haber-Kreisprozess bestimmen. Die theoretische Bestimmung erfolgt durch die Born-Landé-Gleichung und Kapustinskii-Gleichung.
Gittereigenschaften
Da sich das elektrostatische Feld gleichmäßig in alle Raumrichtungen erstreckt, entstehen sehr regelmäßige Ionengitter. Aufgrund der unterschiedlichen Ionenradien ergeben sich allerdings verschiedene ionische Strukturen: Kochsalz- (NaCl), Caesiumchlorid- (CsCl), Zinkblende- (ZnS) und Fluorit-Struktur (CaF2) sowie andere, die nach den charakteristischen Vertretern benannt sind. Die relativen Stabilitäten der verschiedenen Gittertypen infolge verschiedener Koordinationsstrukturen und Koordinationszahlen der Ionen werden durch die Madelung-Konstanten widergespiegelt; diese sind charakteristisch für die jeweilige Struktur.
Charakteristische Eigenschaften von Verbindungen mit Ionenbindung
- Kristallbildung als Feststoff
- Salze dissoziieren in wässriger Lösung in ihre entsprechenden Ionen; Ionenverbindungen lösen sich im Wasser – allerdings in sehr unterschiedlichem Maß. So ist zum Beispiel Natriumchlorid sehr gut in Wasser löslich, Silberchlorid dagegen nahezu unlöslich.
- Hoher Schmelz– und Siedepunkt, weil in Kristallen durch die ungerichteten Bindungskräfte ein relativ stabiler Verbund über den gesamten Kristall entsteht.
- Stromleitend in der Schmelze oder in Lösung. Den Ladungstransport übernehmen die Ionen. Sie werden an den Elektroden entladen, wodurch die Salze zersetzt werden (häufig in ihre Elemente). Daher nennt man Ionenleiter Leiter 2. Ordnung.
- Hart und spröde: Bei dem Versuch, einen Kristall plastisch zu verformen, zerspringt dieser im Normalfall, da im Kristall die gleich geladenen Ionen zueinander geschoben werden und die Bindung dadurch aufgelöst wird.
- Ionenkristalle von Elementen der Hauptgruppen sind oft farblos, da die Valenzelektronen meist stark gebunden sind und nur durch Photonen höherer Energie als der des sichtbaren Lichtes angeregt werden können.
Einzelnachweise
- ↑ Charles E. Mortimer, Ulrich Müller: Chemie. Das Basiswissen der Chemie. Mit Übungsaufgaben. 6. Auflage. Thieme Georg Verlag, 1996, ISBN 3-13-484306-4.
Weblinks
License Information of Images on page#
| Image Description | Credit | Artist | License Name | File |
|---|---|---|---|---|
| Eigenes Werk | Benjah-bmm27 | Datei:Calcium-fluoride-3D-ionic.png | ||
| Auftragung des prozentualen Ionenbindungsanteils gegen die Elektronendifferenz | Eigenes Werk | Brisbane | Datei:Ionen-Charakter.png | |
| Estructura de Lewis del Cloruro de sodio (NaCl). | Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird angenommen, dass es sich um ein eigenes Werk handelt (basierend auf den Rechteinhaber-Angaben). | Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird Eloy als Autor angenommen (basierend auf den Rechteinhaber-Angaben). | Datei:NaCl-Obtención-2.svg | |
| Wikibooks logo; Favicon is | Eigenes Werk | Bastique , Ramac et al. | Datei:Wikibooks-logo.svg | |
| Datei:Wiktfavicon en.svg |

