Metallische Bindung
Als metallische Bindung oder Metallbindung bezeichnet man die chemische Bindung, wie sie bei Metallen und in Legierungen vorliegt. Diese ist durch das Auftreten von frei beweglichen (delokalisierten) Elektronen im Metallgitter gekennzeichnet, die unter anderem für die makroskopischen Eigenschaften elektrische Leitfähigkeit, metallischer Glanz und Duktilität (Schmiedbarkeit bzw. Verformbarkeit) verantwortlich sind. Sie wird durch elektrostatische Anziehungskräfte zwischen Metallionen und freien Elektronen verursacht.
Entstehung
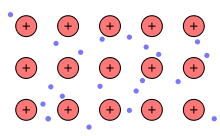
Die Entstehung der metallischen Bindung veranschaulicht man sich folgendermaßen: Außenelektronen (Valenzelektronen) der Metalle, die sich auf der äußersten Schale befinden, sind nur schwach gebunden und können daher leicht vom Atom abgetrennt werden. Im Metall bildet sich deshalb ein Gitter aus (periodisch angeordneten) positiv geladenen Metallionen, den sogenannten Atomrümpfen, welche jeweils die Rumpfladung tragen. Die abgegebenen Außenelektronen sind nun nicht mehr einem einzelnen Atom zugeordnet und können sich innerhalb des Gitters nahezu frei bewegen. Man spricht von einem Elektronengas oder einer Elektronengaswolke. Das Elektronengas lässt sich als Fermigas (nach dem italienischen Physiker Enrico Fermi) beschreiben. Als Folge der elektrostatischen Anziehung zwischen den Atomrümpfen und dem Elektronengas erhält man eine ungerichtete Bindung zwischen den Atomrümpfen und den Elektronen.
Die delokalisierten Elektronen bewirken die gute elektrische Leitfähigkeit und hohe Wärmeleitfähigkeit der Metalle, welche mit steigender Temperatur abnimmt. Grund sind die mit der Temperatur zunehmenden Gitterschwingungen (Phononen), an welchen die Ladungsträger mit steigender Temperatur immer stärker streuen. Diese empirischen Eigenschaften der Metalle lassen sich direkt aus dem Bändermodell ableiten.
Die positiv geladenen Atomrümpfe bilden ein sogenanntes Metallgitter (Metallkristall), in dem sie analog zum Ionengitter periodisch angeordnet sind. Dabei sind verschiedene Gittertypen möglich. Ein kubisch flächenzentriertes Gitter tritt häufig bei Alkali- und Erdalkalimetallen auf. Für Übergangsmetalle ist aufgrund der gerichteten Bindung zwischen den d-Orbitalen auch das raumzentrierte kubische Gitter stabil. Andere Gittertypen sind bei unlegierten Metallen eher selten.
Vorkommen
Eine rein metallische Bindung tritt bei metallischen Elementen (Metallen) und Legierungen (Mischungen von Metallen) auf. Andersartige metallische Festkörper weisen Mischformen von chemischen Bindungen auf. Einige Salze zeigen z.B. eine Übergangsform zwischen ionischer und metallischer Bindung, da diese metallisch glänzen, aber farbig sind, bzw. Strom nur in eine Richtung gut leiten (eindimensionale Metalle). Es ist aber auch gelungen, Kunststoffe (Polymere, die normalerweise durch kovalente Bindung gekennzeichnet sind) mit metallischen Eigenschaften herzustellen. Hier wurden delokalisierte Elektronen in die Substanz durch das gezielte Einfügen von Doppelbindungen „eingebaut“. Bei sehr hohem Druck kann sogar der normalerweise gasförmige Stoff und elektrische Isolator Wasserstoff (H2) metallische Eigenschaften annehmen. Man nimmt an, dass dieser metallische Wasserstoff zum Beispiel in den „Gasriesenplaneten“ Jupiter und Saturn vorkommt.
Dadurch wird deutlich, dass die Ausdrücke kovalente Bindung, ionische Bindung und metallische Bindung zwar leichter verständlich sind, aber für Zwischenbereiche die Molekülorbitaltheorie bessere Beschreibungen und Vorhersagen treffen kann.
Intramolekulare Wechselwirkungen: Ionische Bindung | Kovalente Bindung | Metallische Bindung | Koordinative Bindung
Intermolekulare Wechselwirkungen: Wasserstoffbrücken | Dipol-Dipol-Wechselwirkungen | Van-der-Waals-Kräfte
Delokalisierte π-Bindung | Delokalisierte σ-Bindung (Dreizentrenbindung, Vierzentrenbindung)