Spondylitis ankylosans
Spondylitis ankylosans (von altgriechisch σπόνδυλος spóndylos „Wirbel“ und ἄγκυλος ánkylos „gebogen, gebeugt“; latinisiert zu Spondylitis ankylosans „verbiegende/versteifende Wirbelentzündung“), ankylosierende Spondylitis (AS) oder Morbus Bechterew sowie Morbus Strümpell-Marie-Bechterew ist eine chronische entzündlich-rheumatische Erkrankung mit Schmerzen und Versteifung von Gelenken. Sie gehört zur Gruppe der Erkrankungen der Wirbelsäulengelenke (Spondyloarthritiden) und betrifft vorwiegend die Lenden- und Brustwirbelsäule und die Kreuz-Darmbeingelenke (Sakroiliakalgelenke). Außerdem kann es zu Entzündungen der Regenbogenhaut des Auges und selten anderer Organe kommen.
Weitere Synonyme sind Bechterewsche Krankheit (nach Wladimir Michailowitsch Bechterew, 1857–1927) oder Bechterew-Strümpell-Marie-Krankheit oder Morbus Strümpell-Bechterew-Pierre Marie, rheumatoide Spondylitis, Spondylitis ankylopoetica und Spondylarthritis ankylopoetica (in Abwandlung des von Ernst Ziegel geprägten Ausdrucks „Arthritis chronica ankylopoetica“ von Eugen Fraenkel[1] eingeführter Name); das Wort Morbus ist die lateinische (medizinische) Bezeichnung für Krankheit. Seit 2009 ist Morbus Bechterew ein Mitglied der Krankheitsfamilie axiale Spondyloarthritis (axSpA), welche auch die frühen und weniger ausgeprägten Formen von Morbus Bechterew mit einbezieht.[2]
Der Pathologe Carl von Rokitansky prägte im deutschsprachigen Raum den Begriff Spondylitis deformans, der sowohl einen rheumatisch-entzündlichen Prozess als auch einen degenerativen Altersvorgang meinte. Auch die Engländer William A. Sturge (1879)[3] und Henry Hugh Clutton (1883) bezeichneten die Spondylitis ankylosans (englisch heute ankylosing spondylitis[4]) als eine „Spondylitis deformans“.[5]
Axiale Spondyloarthritis (axSpA) ist eine 2009 eingeführte Bezeichnung, die auch frühe Stadien erfassen soll. Die New-York-Kriterien von 1984[6] basierten noch auf der radiologischen Bildgebung. 2009 wurden weitere Merkmale aufgenommen. Dazu gehörten eine Familiengeschichte für axiale Spondyloarthritis, laborchemische Entzündungszeichen (C-reaktives Protein und Blutsenkungsreaktion), das Ansprechen auf die Behandlung mit nichtsteroidalen, antirheumatischen Medikamenten (NSAR), vorangehende Entzündung/en in den Gelenken, Fersen, Sehnenansätzen oder Augen, Biomarker HLA-B27, sowie Befunde aus der Magnetresonanztomographie.[2][7][8] Im Röntgen okkulte Krankheitsfälle können als nicht-radiologische axiale Spondyloarthritis (nr-axSpA) angesprochen werden.
Epidemiologie in Deutschland
Die Prävalenz einer klinisch manifesten AS lag 2014 weltweit zwischen 0.7 und 2 pro Tausend, in Europa war sie am höchsten.[9] Es gibt allerdings eine unbekannt hohe Anzahl von unentdeckten Fällen. Eine Studie an Blutspendern in Berlin fand unter 348 angeschriebenen Personen (bzw. 273 Antworten) sogar sieben Fälle, d. i. 2 %.[10] Die Gesundheitsberichterstattung des Robert-Koch-Instituts ging im Jahr 2010 von 0,5 % aus.[11] Viele der mit eher milden Symptomen einhergehenden Erkrankungen werden nie diagnostiziert, so dass nur eine Minderheit der geschätzten knapp 1,6 Millionen Menschen mit Spondylarthropathien in Deutschland davon wissen dürfte. Die Deutsche Vereinigung Morbus Bechterew e. V. spricht von 450.000 Fällen in Deutschland.[12] Früher dachte man, Männer seien dreimal so häufig betroffen wie Frauen. Heute weiß man, dass beide Geschlechter gleichermaßen betroffen sind. Infolge des meist milderen Verlaufs bei Frauen – zumindest was die Verknöcherung der Wirbelsäule betrifft – wird Morbus Bechterew bei Frauen jedoch seltener diagnostiziert. Die ersten Symptome treten bei Erkrankten in westlichen Industrienationen meist im jungen Erwachsenenalter (20–25 Jahre) auf, in fünf Prozent der Fälle liegt der Erkrankungsbeginn nach dem 40. Lebensjahr.
Ursachen
Obwohl die Ursachen der Spondylitis ankylosans nicht vollständig bekannt sind, scheinen sie in einer Störung des Immunsystems zu liegen. Da nach der therapeutischen Hemmung des Tumornekrosefaktors-α (TNF-α) eine Linderung der Symptome eintritt,[13] liegt es nahe zu vermuten, dass dieser eine zentrale Rolle im Entstehungsprozess der Erkrankung spielt. Im entzündeten Kreuzbein-Darmbeingelenk treten T-Helferzellen (CD4+ T-Lymphozyten), cytotoxische T-Zellen (CD8+ T-Lymphozyten) und Fresszellen auf, außerdem erhöhte Konzentrationen von TNF-α, obwohl kein Auslöser hierfür feststellbar ist. Eine Ursache könnten jedoch autoimmunologische Phänomene gegen das im Knorpel vorhandene und für seine Elastizität mitverantwortliche Proteoglykan Aggrecan sein.[14] Gemeinsamkeiten in Antigenen von Proteoglykanen könnten die Verteilung der betroffenen Stellen im Körper erklären. Bei vielen Patienten treten außerdem im Blut erhöhte Antikörper-Titer gegen Enterobakterien auf, es gibt jedoch bisher keine Hinweise, dass diese eine Rolle im Krankheitsverlauf spielen.[15]
Eine Besonderheit ist die enge Assoziation der Erkrankung mit der Präsenz von HLA-B27, einem Histokompatibilitäts-Antigen-Subtyp von dem auf fast allen Körperzellen vorhandenen membrangebundenen Protein HLA-B (Human Leukocyte Antigen). Das HLA-B27-Gen liegt, wie die anderen Gene des MHC, auf dem kurzen Arm des sechsten Chromosoms. Das HLA-B27-Genprodukt gehört zur Klasse der MHC-Klasse-I-Proteine, welche Bruchstücke von intrazellulären Erregern (sogenannte Antigene) binden und an der Zelloberfläche präsentieren. Dessen je nach Ethnie verschieden häufiges Vorkommen steht in Beziehung zur Häufigkeit der Erkrankung. Es wird heute davon ausgegangen, dass die ankylosierende Spondylitis größtenteils genetisch bedingt ist, wobei das HLA-B27-Gen der mit Abstand am besten bekannte Marker, jedoch nicht die einzige auslösende genetische Ursache ist.[16] Das Risiko, am Morbus Bechterew zu erkranken, ist bei HLA-B27-Trägern gegenüber der Allgemeinbevölkerung um das Neunzigfache erhöht.[17]
Es gibt Studien, die darauf hinweisen, dass IgA-Antikörper, die gegen das Bakterium Klebsiella pneumoniae gerichtet sind, mit Komponenten des HLA-B27-Moleküls (genau: B*27-05 sowie davon abgeleitete Subtypen) kreuzreagieren, das heißt, dass Antikörper, die bei einer Abwehrreaktion gegen Klebsiella pneumoniae gebildet werden, sich nicht nur gegen dieses Bakterium, sondern aufgrund molekularer Mimikry auch gegen körpereigene Strukturen richten und damit eine Autoimmunreaktion, wie sie auch bei Spondylitis ankylosans auftritt, auslösen können.[18][19][20]
Pathologie
Hauptvorgang bei Spondylitis ankylosans ist die Entzündung der Sehnenansätze, besonders an Becken und Wirbelsäule. Begleitet wird diese durch Ödeme und Schäden am Knochenmark, das dann verknöchert. Die Entzündung des Kreuzbein-Darmbeingelenks (Sakroiliitis) ist eine der ersten Erscheinungen. Betroffen sind dabei sowohl Sehnenansatz als auch Gelenkkapsel. Unterhalb des Gelenkknorpels bildet sich Granulationsgewebe, mit Infiltration durch Lymphozyten und Makrophagen. Die beschädigten Ränder der Gelenke werden zuerst durch Faserknorpel ersetzt, verknöchern dann aber, wodurch das Gelenk versteift wird. In der Wirbelsäule kommt es durch diesen Prozess zur Bildung von Knochenspangen (Syndesmophyten), die benachbarte Wirbel überbrücken. Dies führt zur Bildung der sogenannten Bambuswirbelsäule. Weitere Schäden an der Wirbelsäule sind Osteoporose, Abnutzung der Wirbelkörper an den Rändern und Entzündung mit anschließender Zerstörung der Übergänge zwischen Bandscheibe und Knochen.
Klinisches Bild
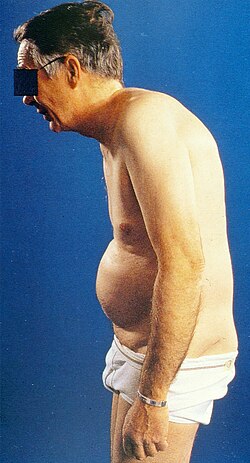
Die ersten Symptome treten meistens in der späten Jugend oder im frühen Erwachsenenalter auf. Zuerst äußern sie sich in stumpfem Schmerz in der Lenden- und Gesäßregion. Dazu kommt oft morgendliche Steifheit, die sich mit Bewegung lindert beziehungsweise nach Ruhephasen wiederkehrt. Innerhalb weniger Monate ist der Schmerz anhaltend und meist beidseitig.
Etwa 25 bis 35 % der Patienten klagen über durch Arthritis verursachte Schmerzen in Schulter-, Hüft- und Kreuzbein-Darmbeingelenk (Sakroiliitis). Dies tritt zumeist mit Bewegungseinschränkungen und Schmerzen auf. Arthritis in anderen Gelenken tritt bei 30 % der Patienten auf, häufig asymmetrisch. Es kommt zu schmerzhaften Entzündungen der Sehnenansätze (Enthesopathien). Besonders betroffen sind hier die Achillessehne, die Plantaraponeurose in der Fußsohle und Sehnenansätze an Oberschenkelknochen und Becken (Trochanteren, Sitzbein, Beckenkamm). Weiterhin verliert die Wirbelsäule durch knöcherne Überbauung („Verknöcherung“) der Zwischenwirbelbereiche durch Syndesmophyten an Mobilität. Die für eine ankylosierende Spondylitis pathognomonische Verknöcherung des Iliosakralgelenks wurde bereits von John Hunter und Eduard Sandifort beobachtet.
Der Krankheitsverlauf ist sehr variabel: Er reicht von leichter Steifheit bis hin zur kompletten Verschmelzung der Wirbel mit damit einhergehender Bewegungseinschränkung des Oberkörpers, beidseitiger Arthritis des Hüftgelenks, Arthritis der Gelenke in den Gliedmaßen und Manifestationen außerhalb der Gelenke. In typisch verlaufenden unbehandelten Fällen treten charakteristische Veränderungen an der Haltung des Patienten auf. Die Lendenlordose (Vorwärtskrümmung) der Wirbelsäule verschwindet, die Gesäßmuskeln verkümmern (Atrophie) und die Kyphose (Rückwärtskrümmung) der Brustwirbelsäule wird ausgeprägter.
Eine schwerwiegende Komplikation der Erkrankung ist ein Knochenbruch innerhalb der Wirbelsäule. Die porösen Knochen können schon bei leichtem Trauma brechen, womit die Gefahr der Verletzung des Rückenmarks besteht.
Eine häufige Erscheinung der Spondylitis ankylosans außerhalb der Gelenke ist eine akute anteriore Uveitis (Entzündung der mittleren Augenhaut). Sie tritt zumeist nur auf einer Seite auf und ist begleitet von Lichtscheu und erhöhter Tränenproduktion. Begleiterscheinungen sind grauer und grüner Star. Bei einem Großteil der Patienten treten außerdem Entzündungen des Dickdarms und Krummdarms auf. Diese sind üblicherweise asymptomatisch; in fünf bis zehn Prozent der Fälle schreiten sie jedoch zu chronisch-entzündlichen Darmerkrankungen fort. Seltenere Begleiterscheinungen sind Schädigungen der Lunge, eine Aorteninsuffizienz und andere Funktionsstörungen im Bereich des Herzens.
Diagnostik
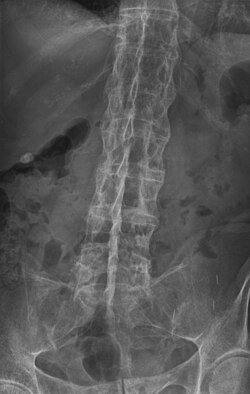
Das Kreuzbein-Darmbeingelenk ist das „Schlüsselgelenk“ der Spondylitis ankylosans. Bei circa 99 Prozent der Patienten gibt sich die Erkrankung radiologisch zuerst an den Kreuzbein-Darmbeingelenken zu erkennen. Charakteristisch ist eine bilaterale Kreuzbein-Darmbeingelenk-Arthritis mit dem Nebeneinander von Knochenabbau und -anbau, subchondralen Sklerosen und beginnender Ankylose (radiologische Graduierung 1–4). Eine gesicherte AS besteht, wenn eine unilaterale Sakroiliitis Grad 3–4 oder bilaterale Sakroiliitis Grad 2–4 und ein klinisches Kriterium bestehen. Laboruntersuchungen sind bei der SA weniger hilfreich. Nur in circa 30–40 Prozent der Fälle finden sich Erhöhungen der Blutsenkung oder des C-reaktiven Proteins. Mit der Erkrankung einhergehende Bewegungseinschränkungen können durch einfache Untersuchungen genauer bestimmt werden (Schober-Maß, Ott-Maß,[21] Menell-Zeichen, Kinn-Brustbein-Abstand, Hinterkopf-Wand-Abstand, atemabhängige Änderung des Brustumfangs).
Differentialdiagnostisch muss Morbus Bechterew von anderen Erkrankungen des Bewegungsapparates wie Osteoporose, Bandscheibenvorfall sowie bakteriellen Entzündungen und Tumorerkrankungen der Wirbelkörper unterschieden werden.
Der Zeitraum bis zur Diagnose beträgt nach Informationen der Deutschen Vereinigung Morbus Bechterew (DVMB) im Durchschnitt fünf bis sieben Jahre, in einigen Fällen jedoch bis zu 15 Jahre. Eine frühzeitige Diagnose ist wichtig, um bleibende Verformungen des Bewegungsapparates zu vermeiden. Während das Vollbild des Morbus Bechterew durch die radiologischen Veränderungen in den Sakroiliakalgelenken und der Wirbelsäule diagnostiziert werden kann, gibt es derzeit keine direkten Tests (Blut oder bildgebende Verfahren), um frühe oder weniger ausgeprägte Formen (nicht-radiologische axiale Spondyloarthritis) eindeutig zu diagnostizieren.
SpA-Kriterien der ASAS
Zur Klassifikation gibt es seit 2009 die Kriterien der ASAS (Assessment of SpondyloArthritis international Society):[2][7] Die ASAS-Kriterien erfordern zunächst chronische Rückenschmerzen (mindestens 3 Monate) und ein Patientenalter von < 45 Jahren bei Beginn der Symptomatik. Dazu kommen entweder Befunde aus der Bildgebung und mindestens ein klinisches SpA-Kriterium (s. folgende Liste), oder der HLA-B27-Nachweis und mindestens zwei klinische SpA-Kriterien. Damit werden eine Sensitivität von 83 und eine Spezifität von 84 % erreicht. D.h. es gibt je ein Fünftel falsch positive und falsch negative Diagnosen. Dennoch werden die ASAS-Kriterien in Ermangelung einer besseren Lösung auch in der Routineversorgung empfohlen.[22]
- Klinische Kriterien der ASAS
- Chronisch entzündliche Rückenschmerzen (schleichender Beginn, Besserung durch Bewegung, keine Besserung der Schmerzen durch Ruhe, nächtliches Erwachen wegen Schmerzen, die sich durch Aufstehen und Bewegen verbessern)
- Entzündungen an Gelenken, Sehnenansätzen oder an Fingern oder Zehen
- Auftreten von axialer Spondyloarthritis in der Familie
- Gutes Ansprechen auf die Behandlung mit nichtsteroidalen antirheumatischen Medikamenten (NSAR)
- Anzeichen einer erhöhten Entzündung (C-reaktives Protein und Blutsenkungsreaktion)
- Auftreten von verwandten Krankheiten wie Schuppenflechte (Psoriasis), chronisch-entzündliche Darmerkrankungen (Morbus Crohn) oder Augenentzündungen (Uveitis)[23]
Bildgebung

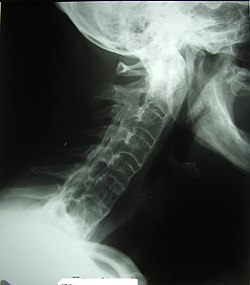
Erosion, reaktive Verkalkungen, und Verknöcherung der Articulatio sacro-iliaca waren seit den 1930er Jahren die ersten pathognomonische Symptome der Spondylitis ankylosans. In späteren Stadien kann es zu Knochenspangen zwischen benachbarten Wirbeln und Verknöcherungen des Wirbelkörperbandapparates kommen. Die Verknöcherung der Wirbelsäule ist auf Röntgenbildern gut zu erkennen und wird wegen ihrer markanten Form auch als Bambuswirbelsäule bezeichnet.
Die modifizierten New-York-Kriterien (1984) waren lange Zeit der Goldstandard für die Diagnose von Morbus Bechterew. Außer den klinischen Symptomen (tiefsitzender Rückenschmerz und Steifheit für mehr als drei Monate, verbessert durch Bewegung) gehörten dazu die im Röntgenbild sichtbaren Zeichen einer beidseitigen Sakroiliitis Grad 2–4, oder einseitig Grad 3–4. Heutzutage werden die meisten Fälle frühzeitig durch die Kernspintomographie dargestellt, die die Veränderungen wesentlich früher zeigt als klassische Röntgenaufnahmen.
Laborbefunde
Es gibt keinen eindeutigen Labortest für eine Spondylitis ankylosans. 90 % der Betroffenen haben das HLA-B27-Gen, allerdings kommt dieses Gen bei etwa 9 % der deutschen Bevölkerung vor. Das Vorkommen dieses Gens ist also lediglich ein Risikofaktor, der die Wahrscheinlichkeit zu erkranken erhöht, die große Mehrheit der Genträger bleibt jedoch gesund. In den Laboruntersuchungen zeigen sich Zeichen einer Entzündung, das heißt, die Erythrozytensedimentationsrate (Blutsenkungsgeschwindigkeit), die Konzentration des C-reaktiven Proteins und von Immunglobulin A sind erhöht, in schweren Fällen gelegentlich auch die Aktivität der alkalischen Phosphatase. Der Rheumafaktor ist negativ. Eine leichte Anämie kann vorhanden sein.
Therapie
Die Therapie zielt darauf ab, die Schmerzen zu reduzieren, die körperliche Funktionsfähigkeit zu erhalten, die Steifigkeit zu verringern, strukturelle Läsionen zu verhindern sowie die Arbeits- und Erwerbsfähigkeit zu erhalten.[22] Insgesamt soll eine Remission erreicht oder zumindest die Krankheitsaktivität reduziert werden. Vorhersagen für das Erreichen (Prädiktoren) sind hierfür kurze Erkrankungsdauer, erhöhte Entzündungsparameter und erhaltene Funktionsfähigkeit. Schließlich ist ein wichtiges Ziel, dass die röntgenologische Progression in Gelenken und Wirbelsäule aufgehalten wird.
Es kommen mehrere Behandlungskonzepte zum Tragen, die durch einen Rheumatologen koordiniert werden. Neben Schulungsmaßnahmen sollen insbesondere nichtpharmakologische und pharmakologische Maßnahmen kombiniert werden. Rehabilitative und invasive Maßnahmen wie Injektionen oder Operationen können in einem späteren Verlauf der Erkrankung notwendig sein. Da es sich um eine Entzündungskrankheit handelt, üben die pharmakologische Maßnahmen einen dämpfenden Effekt auf die Entzündungsreaktionen aus.[24]
Nicht-pharmakologische Therapiemaßnahmen
Bewegung und Physiotherapie
Bei der Spondylitis ankylosans ist es wichtig, sich regelmäßig zu bewegen und systematisch Physiotherapie in Anspruch zu nehmen sowie Dehnübungen durchzuführen, um die Gelenke beweglich zu halten und eine Hyperkyphose zu vermeiden. Damit kann die Beweglichkeit des Körpers oft ausreichend erhalten werden. Übungsprogramme vermindern Schmerzen und Steifigkeit und verbessern die Alltagsaktivität.[22] Dies soll parallel zu einer medikamentösen Behandlung erfolgen.[24]
Pharmakologische Therapiemaßnahmen
Durch verschiedene Medikamente können Schmerzen und Entzündungsprozesse reduziert, die Funktionsfähigkeit und eine Steifheit verbessert sowie ein Fortschreiten der Erkrankung gehemmt werden.
Als Mittel der ersten Wahl werden gegen die Schmerzen wie auch als kausale, antientzündliche Therapie nichtsteroidale Antirheumatika (NSARs bzw. NSAIDs) wie z. B. Ibuprofen oder Diclofenac eingesetzt, darüber hinaus bei bestimmten peripheren Formen Sulfasalazin.[24] NSARs wirken aber nicht nachweisbaren entzündlichen Läsionen in der Wirbelsäule entgegen.[22] Je nach Intensität der Beschwerden richten sich Therapiedauer und Dosierung, die Effektivität wird nach zwei bis vier Wochen beurteilt. Bei Therapieversagen soll ein anderes NSAR eingesetzt werden. Sollte ein Patient ausreichend ansprechen, können NSARs kontinuierlich zur Kontrolle der Symptome weiter gegeben werden.
Moderne Medikamente umfassen u.a Interleukin-17 Antikörper Secukinumab und TNF-α-Blocker, wie Etanercept und Adalimumab.[25] Außerdem sollen, Studien zufolge, Pamidronat, ein Bisphosphonat, Thalidomid (der Wirkstoff in Contergan, wirkt vermutlich auch durch Hemmung von TNF-α) und das radioaktive Isotop Radium-224 als Infusion wirksam sein.[26]
Invasive Therapien
Bei Patienten mit einer axSpA im Bereich der Iliosakralgelenke und im Bereich der peripheren Gelenke bzw. Enthesen können intraartikuläre Glucocorticoid-Injektionen (in das Gelenk) erfolgen.[22] Enthesen sind die Stellen am Knochen, an der eine Sehne, ein Ligament oder eine Gelenkkapsel ansetzt. Diese Injektionen wirken im Bereich der muskuloskelettalen Entzündung und können gemäß EULAR-Guideline auch via Ultraschall gelenkt werden.[24] Eine längere Anwendung bei Patienten mit axSpA wird nicht empfohlen.
Bei sehr weit fortgeschrittenen Erkrankungsstadien gibt es operative Therapieoptionen, wie die bereits versteifte Wirbelsäule in einer aufwändigen und komplikationsreichen Operation an mehreren Stellen zu „brechen“ und mit Metallplatten in einer aufrechteren Stellung zu fixieren (Spondylodese), oder aber eine Keilosteotomie.[27]
Prognose
Der Krankheitsverlauf ist häufig schubweise und variiert zwischen verschiedenen Patienten. Einer Invalidisierung kann durch Bechterew-Gymnastik vorgebeugt werden. Bei Frauen verläuft Spondylitis ankylosans häufig milder, eine Versteifung der Wirbelsäule tritt hier seltener auf.
Der Einfluss der Spondylitis ankylosans auf die Lebenserwartung ist umstritten. Einige Studien – wenngleich nicht alle – legen nahe, dass eine Verkürzung der Lebenserwartung auftritt. Todesfälle im Zusammenhang mit Spondylitis ankylosans sind meist Folgen von Verletzungen des Rückenmarks, Ateminsuffizienz, Aorteninsuffizienz oder durch Nebenwirkungen der Behandlung wie Blutungen im oberen Verdauungstrakt bedingt.
Geschichtliche Aspekte
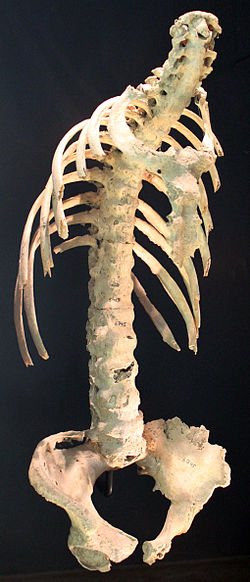
Die ankylosierende Spondylitis (so schon 1904 von Morris Simmonds genannt[28]) trat bereits bei Menschen der Steinzeit (im Neolithikum) auf. Die Verknöcherung von Gelenken und Sehnenansätzen, insbesondere im axialen Skelett, als Hinweise auf eine Erkrankung an Spondylitis ankylosans wurde in Bezug auf Menschen bereits an einer 5000 Jahre alten ägyptischen Mumie entdeckt.[29] Knochenveränderungen im Sinne einer ankylosierenden Spondylose wurden auch bei über 10.000 Jahre alten Resten von Tieren wie dem Höhlenbär (so in der sogenannten Zoolithenhöhle) gefunden und von Rudolf Virchow als „Höhlengicht“ bezeichnet. Dass die ankylosierende Spondylitis in typischer Form bei Tieren vorkommt, wurde jedoch von Jacques Forestier und Mitarbeitern[30] bezweifelt und war auch in den 1960er Jahren noch nicht entschieden.[31]
Der Anatom und Chirurg Realdo Colombo beschrieb 1559 eine Krankheit, deren Symptome ebenfalls auf Spondylitis ankylosans zutreffen;[32] die erste Beschreibung der krankhaften Veränderungen an der Wirbelsäule erfolgte 1691 anhand eines in Frankreich gefundenen Skeletts durch den irischen Medizinstudenten[33] Bernard Connor[34] (ursprünglich O’Connor; 1666–1698)[35] und stellte somit die erste, 1693 erstmals (in Paris auf Französisch[36]) und 1695 in der endgültigen und ausführlichsten Fassung in lateinischer Sprache[37] veröffentlichte Publikation eines Falles von ankylosierender Spondylitis (bei Connor stupendus ossium coalitus)[38] dar. Eine zweite, englische Fassung war in London 1694[39] als Band 19 der Reihe Philosophical Transactions erschienen.
Bei einem ähnlichen Patienten wurde 1818 durch den Londoner Chirurgen Benjamin Collins Brodie eine Entzündung der Regenbogenhaut dokumentiert.[34] In Band 8 der von der Kaiserlich-Leopoldinischen Akademie der Naturforscher herausgegebenen Acta physico-medica sive Ephemerides publizierte Johann Sebastian Albrecht 1748 über die mit Verkrümmung verbundene Ankylose der Wirbelsäule. Englische Autoren lieferten klinische Beschreibungen von atypischen Formen der Erkrankung ab 1824.
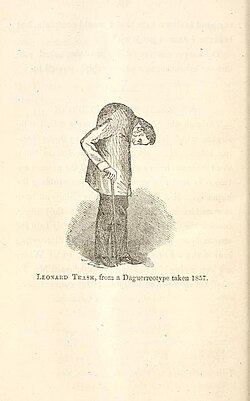
Die erste eindeutige klinische Beschreibung des typischen Krankheitsbildes der Spondylitis ankylosans gab Benjamin Collins Brodie 1850 im vierten Abschnitt („über einige Krankheitsfälle, welche mit Karies der Wirbelsäule verwechselt werden können“) des zwölften Kapitels seiner in fünfter Auflage erschienenen Schrift Pathological and Surgical Oberservations on the Diseases of the Joints.[40] Im Jahr 1858 veröffentlichte David Tucker eine Broschüre, in der er den Fall eines Patienten namens Leonard Trask beschreibt, der an einer schweren Missbildung der Wirbelsäule infolge von Spondylitis ankylosans litt.[41] Dies war der erste dokumentierte Fall von Spondylitis ankylosans in den USA.
Der erste promovierte Mediziner, der über die ankylosierende Spondylitis schrieb, war 1877 Charles Hilton Fagge (1838–1883),[42] ein Arzt an Guy’s Hospital in London, der die „Osteoarthritis“ deutlich gegen die Spondylose abgrenzte und mit seiner Publikation durch die von Carl Wenzel und von Brodie vergeblich angestrebte Verbindung des klinischen mit dem anatomischen das Krankheitsbild der ankylosierenden Spondylitis begründete.[43] Erst gegen Ende des neunzehnten Jahrhunderts (1892–1899) erfolgten die ersten vollständigen Beschreibungen der Erkrankung durch Wladimir Bechterew in Russland im Jahre 1892,[44][45] Adolf von Strümpell in Deutschland 1884 (erste Erwähnung in der deutschen Literatur) und genauer (mit der ersten publizierten Photographie eines an Spondylitis ankylosans erkrankten Menschen)[46] 1897[47] und Pierre Marie in Frankreich 1898.[48] Aus diesem Grund wird Spondylitis ankylosans auch als (fälschlicherweise) Morbus Bechterew[49] oder Bechterew-Strümpell-Marie-Krankheit bezeichnet. Bechterew macht 1907 auch Vorschläge zur aus seiner Sicht erfolgversprechenden Behandlung dieser Ankylose.[50]
Dank Maries (und dessen Schülern, insbesondere André Léri) Arbeiten hat diese Erkrankung (von Marie spondylose rhizomélique – von griechisch ῥίζα „Wurzel“, und μέλος „Glied“ – genannt, da das Wirbelleiden auch die Gelenke an den Wurzeln der Glieder erfasst) um 1900 ihre Anerkennung als Krankheit eigener Prägung gefunden.[51]
Eine Augenbeteiligung als Merkmal des Krankheitsbildes berichtete erstmals Sturge. Er nannte eine durchgemachte Iritis.[52] Die vergleichende Forschung zeigt eine hohe Korrelation der Spondylitis ankylosans mit dem chronischen Erysipeloid (Rotlauf) des Schweins. Diese Erkrankung wird durch Erysipelothrix rhusiopathiae ausgelöst und führt bei chronischem Verlauf zu einem nahezu identischen Bild. Veterinärmedizinisch wird dies als Karpfen- oder „Fischwirbelsäule“ bezeichnet. Entsprechende Untersuchungen beim Menschen stehen noch aus. Untersuchungen an HLA-B27-positiven transgenen Versuchstieren konnten zeigen, dass diese primär im Zustand einer Gnotobiose gehaltenen Tiere erst beim Kontakt mit der überall vorkommenden Mikroflora erkranken und das Vollbild des M. Bechterew entwickelten.
Patientenorganisationen
Folgende deutschsprachige Patientenorganisationen bieten Informationen und Hilfestellungen im Umgang mit Morbus Bechterew an und fördern den Erfahrungsaustausch mit anderen Betroffenen:
| Land | Name | Website |
|---|---|---|
| Deutschland | Deutsche Vereinigung Morbus Bechterew | https://www.bechterew.de/ |
| Österreich | Österreichische Vereinigung Morbus Bechterew | https://www.bechterew.at/ |
| Schweiz | Schweizerische Vereinigung Morbus Bechterew | https://www.bechterew.ch/ |
Siehe auch
Literatur
Leitlinien
- S3-Leitlinie Axiale Spondyloarthritis inklusive Morbus Bechterew und Frühformen der Deutschen Gesellschaft für Rheumatologie und Klinische Immunologie. In: AWMF online (Stand 2019)
- Sofia Ramiro et al.: ASAS-EULAR recommendations for the management of axial spondyloarthritis: 2022 update. In: Annals of the Rheumatic Diseases. Band 82, Nr. 1, Januar 2023, S. 19–34, doi:10.1136/ard-2022-223296, PMID 36270658 (englisch).
- Michael M. Ward et al.: 2019 Update of the American College of Rheumatology/Spondylitis Association of America/Spondyloarthritis Research and Treatment Network Recommendations for the Treatment of Ankylosing Spondylitis and Nonradiographic Axial Spondyloarthritis. In: Arthritis & Rheumatology (Hoboken, N.J.). Band 71, Nr. 10, Oktober 2019, S. 1599–1613, doi:10.1002/art.41042, PMID 31436036, PMC 6764882 (freier Volltext) – (englisch).
Fachliteratur
- Heinrich Buess, Huldrych M. Koelbing: Kurze Geschichte der ankylosierenden Spondylitis und Spondylose. J. R. Geigy, Basel 1964 (= Acta rheumatologica. Nr. 22).
- Wolfgang Miehle: Ankylosierende Spondylitis (Morbus Bechterew). Rheumamed-Verlag, Samerberg 2006, ISBN 3-9810960-5-3.
- Féline P. B. Kroon et al.: Non-steroidal anti-inflammatory drugs (NSAIDs) for axial spondyloarthritis (ankylosing spondylitis and non-radiographic axial spondyloarthritis). In: The Cochrane Database of Systematic Reviews. Band 2015, Nr. 7, 17. Juli 2015, S. CD010952, doi:10.1002/14651858.CD010952.pub2, PMID 26186173, PMC 8942090 (freier Volltext) – (englisch).
- Jürgen Braun et al.: Versorgungssituation von Patienten mit ankylosierender Spondylitis und Psoriasisarthritis in Deutschland. In: Zeitschrift für Rheumatologie. Band 78, Nr. 4, 1. Mai 2019, S. 372–381, doi:10.1007/s00393-019-0619-6.
- Herbert Kellner, Maria L. Voulgari: Spondylitis ankylosans (Morbus Bechterew). In: CME. Band 20, Nr. 9, 1. September 2023, S. 55–66, doi:10.1007/s11298-023-3267-8.
Patientenratgeber
- Paul Schmied, Heinz Baumberger: Morbus Bechterew. Der entzündliche Wirbelsäulen-Rheumatismus. Ein Leitfaden für Patienten und deren Angehörige, für Ärzte, Physiotherapeuten, Pflegepersonal und Sozialarbeiter. 3. Auflage. Urban & Fischer, München u. a. 2003, ISBN 3-437-45706-3.
- Wolfgang Miehle: Spondylitis ankylosans – Morbus Bechterew. Informationen über Bewährtes und Neues für Diagnose und Therapie. Rheumamed-Verlag, Samerberg 2004, ISBN 3-9806607-2-9.
Weblinks
Einzelnachweise
- ↑ Vgl. etwa Eugen Fraenkel: Über chronische ankylosierende Wirbelsäulenversteifung. In: Fortschr. Röntgenstr. Band 7, 1903/1904, S. 62 ff., und Band 11, 1907/1908, S. 171 ff.
- 1 2 3 Martin Rudwaleit, D. van der Heijde, R. Landewe und andere: The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part II): validation and final selection. In: Annals of the Rheumatic Diseases. 68. Jahrgang, Nr. 6, 2009, S. 777–783. doi:10.1136/ard.2009.108233.
- ↑ William A. Sturge: A case of spondylitis deformans. In: Trans. clin. Soc. Lond. Band 12, 1879, S. 204 ff.
- ↑ Vgl. auch D. O’Connell: Ankylosing spondylitis; the literature up to the close of the nineteenth century. In: Ann. rheum. Dis. Band 15, 1956, S. 119 ff.; sowie P. A. Zorab: The historical and prehistorical background of ankylosing spondylitis. In: Proceedings of the Royal Society of Medicine. Band 54, 1961, S. 415 ff.
- ↑ Heinrich Buess, Huldrych M. Koelbing: Kurze Geschichte der ankylosierenden Spondylitis und Spondylose. J. R. Geigy, Basel 1964 (= Acta rheumatologica. Nr. 22), S. 60, 64 und 79.
- ↑ Sjef Van Der Linden, Hans A. Valkenburg, Arnold Cats: Evaluation of Diagnostic Criteria for Ankylosing Spondylitis. In: Arthritis & Rheumatism. 27. Jahrgang, Nr. 4, 1984, ISSN 0004-3591, S. 361–368, doi:10.1002/art.1780270401.
- 1 2 Denis Poddubnyy, Astrid van Tubergen, Robert Landewé, Joachim Sieper, Désirée van der Heijde: Development of an ASAS-endorsed recommendation for the early referral of patients with a suspicion of axial spondyloarthritis. In: Annals of the Rheumatic Diseases. 74. Jahrgang, Nr. 8, 2015, ISSN 0003-4967, S. 1483–1487, doi:10.1136/annrheumdis-2014-207151.
- ↑ Désirée van der Heijde, Anna Molto, Sofia Ramiro, Jürgen Braun, Maxime Dougados, Floris A van Gaalen, Lianne S Gensler, Robert D Inman, Robert B M Landewé, Helena Marzo-Ortega, Victoria Navarro-Compán, Andri Phoka, Denis Poddubnyy, Mikhail Protopopov, John Reveille, Martin Rudwaleit, Percival Sampaio-Barros, Alexandre Sepriano, Joachim Sieper, Filip E Van den Bosch, Irene van der Horst-Bruinsma, Pedro M Machado, Xenofon Baraliakos: Goodbye to the term ‘ankylosing spondylitis’, hello ‘axial spondyloarthritis’: time to embrace the ASAS-defined nomenclature. In: Annals of the Rheumatic Diseases. Band 83, Nr. 5, Mai 2024, ISSN 0003-4967, S. 547–549, doi:10.1136/ard-2023-225185 (bmj.com [abgerufen am 18. Mai 2024]).
- ↑ Linda E. Dean, Gareth T. Jones, Alan G. MacDonald, Christina Downham, Roger D. Sturrock, Gary J. Macfarlane: Global prevalence of ankylosing spondylitis. In: Rheumatology (Oxford, England). Band 53, Nr. 4, April 2014, ISSN 1462-0332, S. 650–657, doi:10.1093/rheumatology/ket387, PMID 24324212.
- ↑ J. Braun, M. Bollow, G. Remlinger u. a.: Prevalence of Spondylarthropathies in HLA-B27 positive and negative blood donors. In: Arthritis & Rheumatism. Band 41, 1998, S. 58–67. PMID 9433870.
- ↑ Angela Zink, Kirsten Minden, Sabine M. List: Ankylosierende Spondylitis. In: Robert-Koch-Institut (Hrsg.): Gesundheitsberichterstattung des Bundes. Heft 49, Entzündlich-rheumatische Erkrankungen, 14. Juni 2010, S. 11 (rki.de [PDF]).
- ↑ Deutsche Vereinigung Morbus Bechterew e. V.: Diagnose Morbus Bechterew. Abgerufen am 18. Mai 2024.
- ↑ J. Braun, J. Sieper: Therapy of ankylosing spondylitis and other spondyloarthritides: established medical treatment, anti-TNF-alpha therapy and other novel approaches. In: Arthritis Res. 2002;4 (5): S. 307–321. PMID 12223105.
- ↑ J. Zou, Y. Zhang, A. Thiel, M. Rudwaleit, S. L. Shi, A. Radbruch, R. Poole, J. Braun, J. Sieper: Predominant cellular immune response to the cartilage autoantigenic G1 aggrecan in ankylosing spondylitis and rheumatoid arthritis. In: Rheumatology. Band 42, Nr. 7, Juli 2003, S. 846–855. PMID 12730543.
- ↑ C. G. van Bohemen, A. J. Nabbe, H. S. Goei The, A. J. Dekker-Saeys, H. C. Zanen: Antibodies to Enterobacteriaceae in ankylosing spondylitis. In: Scand J Rheumatol. Band 15, Nr. 2, 1986, S. 143–147. PMID 3092349.
- ↑ Mehr zu HLA-B27 (engl.): P. Bowness: HLA B27 in health and disease: a double-edged sword? In: Rheumatology. Band 41, Nr. 8, August 2002, S. 857–868, PMID 12154202 (Review).
- ↑ Abul K. Abbas: Diseases of Immunity. In: Vinay Kumar, Abul K. Abbas, Nelson Fausto: Robbins and Cotran – Pathologic Basis of Disease. 7. Auflage. Philadelphia, 2005, S. 205.
- ↑ Mehr zu Klebsiella pneumoniae vs. HLA-B27: M. Ogasawara, D. H. Kono, D. T. Yu: Mimicry of human histocompatibility HLA-B27 antigens by Klebsiella pneumoniae. In: Infection and Immunity. Band 51, Nr. 3, März 1986, S. 901–908. PMID 3512439. PMC 260984 (freier Volltext).
- ↑ T. Rashid, A. Ebringer: Anklyosing spondylitis is linked to Klebsiella-the evidence Springer, In: Clin Rheumatol. Band 26, 2007 S. 858–864.
- ↑ A. Ebringer, T. Rashid, C. Wilson u. a.: Ankylosing spondylitis, HLA B27 and Klebsiella-an overview: proposal for eraly diagnosis and treatment. In: Curr. Rheumatol. Rev. 2, 2006, S. 55–68.
- ↑ Vgl. Victor Rudolf Ott, H. Wurm: Spondylitis ankylopoetica (Morbus Strümpell-Marie-Bechterew). 2. Auflage. Steinkopff, Darmstadt 1957.
- 1 2 3 4 5 S3-Leitlinie Axiale Spondyloarthritis inklusive Morbus Bechterew und Frühformen der Deutschen Gesellschaft für Rheumatologie und Klinische Immunologie. In: AWMF online (Stand 2019)
- ↑ ASAS Handbook – ASAS. 9. Juli 2020, abgerufen am 14. Mai 2024 (amerikanisches Englisch).
- 1 2 3 4 Sofia Ramiro et al.: ASAS-EULAR recommendations for the management of axial spondyloarthritis: 2022 update. In: Annals of the Rheumatic Diseases. Band 82, Nr. 1, 1. Januar 2023, S. 19–34, doi:10.1136/ard-2022-223296, PMID 36270658 (englisch).
- ↑ Wirkstoff aktuell 04/2006, eine Publikation der Arzneimittelkommission der deutschen Ärzteschaft (PDF; 82 kB).
- ↑ Dennis L. Kasper u. a.: Harrison's Principles of Internal Medicine. 16. Ausgabe. 2005, S. 1995 f.
- ↑ M. Ruf, R. Wagner, H. Merk, J. Harms: Präoperative Planung und navigationsgestützte Keilosteotomie bei Morbus Bechterew. In: Zeitschrift für Orthopädie und ihre Grenzgebiete. Band 144, 2006, S. 52, doi:10.1055/s-2006-921484.
- ↑ Vgl. Morris Simmonds: Über Spondylitis deformans und ankylosierende Spondylitis. In: Fortschr. Rontgenstr. Band 7, 1903/1904, S. 51 ff.
- ↑ A. Calin: Ankylosing spondilitis. In: Clinics in Rheumatic Diseases. Band 11, 1985, S. 41–60.
- ↑ Vgl. Jacques Forestier, F. Jacqueline, Jaume Rotes-Querol: La spondylarthrite ankylosante. Masson, Paris 1951.
- ↑ Heinrich Buess, Huldrych M. Koelbing: Kurze Geschichte der ankylosierenden Spondylitis und Spondylose. J. R. Geigy, Basel 1964 (= Acta rheumatologica. Nr. 22), S. 13–27 (Paläopathologie der ankylosierenden Spondylitis und Spondylose), hier: S. 13–23, 26 und 78.
- ↑ Pierre Marie: Benoist M. – Historical Perspective. In: Spine. Band 20, 1995, S. 849–852.
- ↑ Wolfgang Miehle: Gelenk- und Wirbelsäulenrheuma. Eular Verlag, Basel 1987, ISBN 3-7177-0133-9, S. 55.
- 1 2 Baruch S. Blumberg: ? In: Arch Rheum. Band 1, 1958, S. 553.
- ↑ Baruch Samuel Blumberg, J. L. Blumberg: Bernard Connor (1666–1698) and his contribution to the pathology of ankylosing spondylitis. In: Journal of the History of Medicine. Band 13, 1958, S. 349 ff.
- ↑ Bernard Connor: Lettre écrite à Monsieur le chevalier Guillaume de Waldegrave, premier médecin de sa Majesté Britannique. Paris 1694.
- ↑ Bernard Connor: De stupendo ossium coalitu. Dissertatio medico-physica. Ex Gallico Idiomate in Latinum conversa et Novis Animadversionibus aucta. Theatrum Sheldonianum, Oxford 1695.
- ↑ Heinrich Buess, Huldrych M. Koelbing: Kurze Geschichte der ankylosierenden Spondylitis und Spondylose. J. R. Geigy, Basel 1964 (= Acta rheumatologica. Nr. 22), S. 13–27 (Paläopathologie der ankylosierenden Spondylitis und Spondylose), hier: S. 34, Abb. 25, S. 35–36 (Erste pathologisch-anatomische Beschreibung der ankylosierenden Spondylitis (O’Connor, 1693)), 36–37, 40 und 78.
- ↑ Bernard Connor: An extract of a letter to Sir Charles Walgrave, published in French at Paris: Giving an account of an extraordinary humane sceleton, whose vertebrae of the back, the ribs, and several bones down to the os sacrum, were all firmly united into one solid bone, without joynting or cartilage. In: Phil. Trans. Band 19, 1694, S. 21 ff.
- ↑ Heinrich Buess, Huldrych M. Koelbing: Kurze Geschichte der ankylosierenden Spondylitis und Spondylose. J. R. Geigy, Basel 1964 (= Acta rheumatologica. Nr. 22), S. 36–38, 58–60 und 78.
- ↑ A Brief historical sketch of the life and sufferings of Leonard Trask, the wonderful invalid (1858). Abgerufen am 19. Februar 2013.
- ↑ Charles Hilton Fagge: A case of simple synostosis of the ribs to the vertebrae, and of the arches and the articular processes of the vertebrae themselves, and also of one hip-joint. In: Transactions of the pathological Society of London. Band 28, 1877, S. 201–206.
- ↑ Heinrich Buess, Huldrych M. Koelbing: Kurze Geschichte der ankylosierenden Spondylitis und Spondylose. 1964, S. 60–64 (mit der ins Deutsche übersetzten, die Klinik und die pathologische Anatomie zugleich umfassenden Erstbeschreibung der ankylosierenden Spondylitis von Fagge) und 65.
- ↑ Auf Russisch in der Zeitschrift Wratsch. 1892. Deutsch: Wladimir Bechterew: Steifigkeit der Wirbelsäule und ihre Verkrümmung als besondere Erkrankungsform. In: Neurologisches Centralblatt. Band 12, 1893, S. 426–434.
- ↑ Wladimir von Bechterew: Neue Beobachtungen und pathologisch-anatomische Untersuchungen über die Steifigkeit der Wirbelsäule. In: Deutsche Zeitschrift für Nervenheilkunde. Band 15, 1899, S. 45 ff.
- ↑ Heinrich Buess, Huldrych M. Koelbing: Kurze Geschichte der ankylosierenden Spondylitis und Spondylose. J. R. Geigy, Basel 1964 (= Acta rheumatologica. Nr. 22), S. 64–65 und 78.
- ↑ A. Strümpell: Bemerkung über die chronische ankylosierende Entzündung der Wirbelsäule und der Huftgelenke. In: Dtsch Z Nervenheilkd. Band 11, 1897, S. 338–342.
- ↑ P. Marie: Sur la spondylose rhizomelique. In: Rev Med. Band 18, 1898, S. 285–315.
- ↑ Vgl. hierzu Heinrich Buess, Huldrych M. Koelbing: Kurze Geschichte der ankylosierenden Spondylitis und Spondylose. 1964, 66–67 (Verwischung des Krankheitsbilds durch Bechterew), S. 67 („Die Bezeichnung der ankylosierenden Spondylitis als Morbus Bechterew konnte sich also nur in doppelter Unkenntnis der historischen Quellen einbürgern: Unkenntnis der früheren, besseren Beschreibungen und Unkenntnis von Bechterews Auffassungen zugleich!“) und 78 („Bechterew glaubte, eine eigene Form von Verkrümmung und Versteifung der Wirbelsäule ohne obligate Ankylose, aber mit ausgeprägten Reizerscheinungen der Spinalnerven sowie mit degenerativen Veränderungen des Rückenmarks, der Nervenwurzeln und der Spinalganglien entdeckt zu haben“).
- ↑ Wladimirt von Bechterew: Über die klinischen und pathologisch-anatomischen Besonderheiten der nervösen Form der Steifigkeit und der Ankylose der Wirbelsäule und ihre Behandlung. In: Monatsschrift für Psychiatrie und Neurologie. Band 21, 1907 S. 527 ff.
- ↑ Heinrich Buess, Huldrych M. Koelbing: Kurze Geschichte der ankylosierenden Spondylitis und Spondylose. J. R. Geigy, Basel 1964 (= Acta rheumatologica. Nr. 22), S. 67–74 (Die ankylosierende Spondylitis als Morbus sui generis (Marie, 1898, 1906) und 78).
- ↑ Heinrich Buess, Huldrych M. Koelbing: Kurze Geschichte der ankylosierenden Spondylitis und Spondylose. J. R. Geigy, Basel 1964 (= Acta rheumatologica. Nr. 22), S. 64.
License Information of Images on page#
| Image Description | Credit | Artist | License Name | File |
|---|---|---|---|---|
| Wirbelsäule mit knöchernen Verwachsungen aller Wirbelkörper - Spondylitis ankylosans (morbus bechterew) aus der Gegend von Heilbronn; frühes 6. Jhd.; Württembergisches Landesmuseum Stuttgart | Eigenes Werk | Anagoria | Datei:0510 Spondylitis ankylosans (morbus bechterew) anagoria.JPG | |
| Deckblatt zu Leonard Trask - The wonderful invalid | Scanned and uploaded on en:WP by en:User:Apparent Logic with description This is from an edition I own. It was published over 130 years ago and is now in the public domain. | Datei:AS trask.jpg | ||
| Eingesteifte Thorakalkyphose mit sogenanntem Pressbauch bei Spondylitis ankylosans | eigenes Archiv | Mehlauge | Datei:Bechterew-Kyphose.JPG | |
| The Wikimedia Commons logo, SVG version. | Original created by Reidab ( PNG version ) SVG version was created by Grunt and cleaned up by 3247 . Re-creation with SVG geometry features by Pumbaa , using a proper partial circle and SVG geometry features. (Former versions used to be slightly warped.) | Reidab , Grunt , 3247 , Pumbaa | Datei:Commons-logo.svg | |
| ISG-Arthritis li. 25-jähriger Patient. Schnittbildverfahren: MRT: T1 gewichtete Spin-Echo-Sequenz mit Fettsättigung ("Schwärzung des Fettsignals z.B. im Knochenmark und Unterhautfettgewebe) nach Gabe von Gadolinium (Kernspin-Kontrastmittel). | Eigenes Werk | Lange123 | Datei:M Bechterew2 Spond li ISG MR pcor T1 FatSAT mit GD.jpg | |
| Datei:Merge-arrows.svg | ||||
| Spondyloarthrosis Ankylopoetica, Morbus Bechterew. Neck X-ray. | Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird angenommen, dass es sich um ein eigenes Werk handelt (basierend auf den Rechteinhaber-Angaben). | Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird Jojo als Autor angenommen (basierend auf den Rechteinhaber-Angaben). | Datei:Morbus Bechterew.jpg | |
| The Rod of Asclepius overlaid with a caution symbol | Star of life caution.svg with Nuvola apps important.svg | Gigillo83 | Datei:P medicine caution.svg | |
| Das Zeichen wird dazu genutzt, besonders gut geschriebene Artikel in der deutschsprachigen Wikipedia zu kennzeichnen | File:Qsicon exzellent.png | User:Niabot | Datei:Qsicon Exzellent.svg | |
| Bewertungsicon "Quelle" für Artikel mit fehlenden Quellen. | based on Image:Qsicon_Quelle.png and Image:QS icon template.svg | Hk kng , Image:Qsicon_Quelle.png is by User:San Jose , Image:QS icon template.svg is by User:JesperZedlitz | Datei:Qsicon Quelle.svg |


