Thomsonsches Atommodell
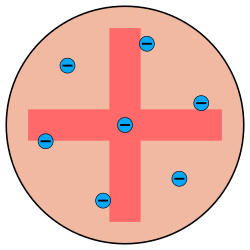
Elektronen: blau
Positiver Hintergrund: rot
Das thomsonsche Atommodell ist ein Atommodell, nach dem das Atom aus gleichmäßig verteilter, positiv geladener Masse besteht, in der sich die negativ geladenen Elektronen bewegen. Dieses Modell wurde 1903 von Joseph John Thomson entwickelt. Aufgrund der angenommenen Anordnung der Elektronen in der Masse, vergleichbar mit Rosinen in einem Kuchen, wird es auch als Plumpudding- oder Rosinenkuchenmodell bezeichnet. Im Grundzustand sind die Elektronen so verteilt, dass ihre potentielle Energie minimal ist. Werden sie angeregt, beginnen sie zu schwingen.
Entstehung
Im Jahr 1897 konnte Joseph John Thomson nachweisen, dass Kathodenstrahlen aus geladenen Teilchen, den Elektronen, bestehen. Durch ein stark verbessertes Vakuum konnte er das Verhältnis von Ladung zu Masse bestimmen. Thomson vermutete, dass die Elektronen bereits in den Atomen der Kathode vorhanden waren, und stellte 1903 das erste Atommodell auf, das den Atomen eine innere Struktur zuschrieb.
Aufbau
In Thomsons ursprünglichem Modell waren alleine die Elektronen für die Masse des jeweiligen Atoms verantwortlich. In einem Wasserstoffatom mussten also schon über 1800 Elektronen vorhanden sein. Dagegen nahm er die ebenfalls vorhandene gleich große positive Ladungsmenge als masselos an. Die positive Ladung füllte das Volumen des Atoms aus und war – außer für Elektronen – undurchdringlich. Zwar wusste Thomson, dass ein solcherart aufgebautes Atom nicht stabil sein konnte, aber er konnte den normalen Zeeman-Effekt damit quantitativ erklären.
Probleme und Verfeinerung
Experimente mit Röntgenstrahlen zeigten Thomson ab 1906, dass die Anzahl der Elektronen deutlich geringer sein musste als von ihm vorhergesagt. Ihre Anzahl konnte in einem Atom nur etwa gleich der Massenzahl des Atoms sein.
Das eine Elektron im Wasserstoffatom führt, wenn es angeregt wird, harmonische Schwingungen durch den Mittelpunkt des Atoms aus und sendet dadurch Licht aus. Dies erlaubt im Gegensatz zur experimentellen Beobachtung jedoch nur eine Spektrallinie.
Der rutherfordsche Streuversuch (1909), durchgeführt von Hans Geiger, Ernest Marsden und Ernest Rutherford, zeigte, dass die positive Ladung in einem Atomkern vereinigt ist und den Großteil der Atommasse ausmacht. Mit Hilfe dieser Erkenntnis wurde das thomsonsche Modell 1911 zum rutherfordschen Atommodell verfeinert.
Literatur
- Joseph John Thomson: On the Structure of the Atom: an Investigation of the Stability and Periods of Oscillation of a number of Corpuscles arranged at equal intervals around the Circumference of a Circle; with Application of the Results to the Theory of Atomic Structure. In: Philosophical Magazine Series 6. 7. Jahrgang, Nr. 39, März 1904, S. 237–265 (uni-tuebingen.de [PDF; abgerufen am 27. September 2022]).
- Hans Geiger, Ernest Marsden: On a Diffuse Reflection of the α-Particles. In: Proceedings of the Royal Society. 82A. Jahrgang, 1909, S. 495–500 (dbhs.wvusd.k12.ca.us ( des vom 24. April 2008 im Internet Archive) [abgerufen am 30. September 2008]).
- Ernest Rutherford: The Scattering of α and β Particles by Matter and the Structure of the Atom. In: Philosophical Magazine (Series 6). 21. Jahrgang, Mai 1911, S. 669–688 (dbhs.wvusd.k12.ca.us ( des vom 17. März 2004 im Internet Archive) [abgerufen am 30. September 2008]).
- Jörn Bleck-Neuhaus: Elementare Teilchen. Von den Atomen über das Standard-Modell bis zum Higgs-Boson. 2., überarbeitete Auflage. Springer, 2013, ISBN 978-3-642-32578-6, ISSN 0937-7433, S. 16, doi:10.1007/978-3-642-32579-3.
License Information of Images on page#
| Image Description | Credit | Artist | License Name | File |
|---|---|---|---|---|
| The plum pudding model of the atom, as proposed by JJ Thomson. | Eigenes Werk | Kurzon | Datei:Plum pudding model.svg |
