Batterie#
von Ilva Leinich, Laura Strametz; BG/BRG Pestalozzi, 7b; Betreuung: Camhy; 71 Punkte;Unterteilung in verschiedene Typen:
#
1. Bei einer Primärbatterie wird beim Entladevorgang die gespeicherte elektrochemische Energie in elektrische Energie umgewandelt. Der Entladevorgang kann nur einmal durchgeführt werden, ein erneutes Aufladen der Batterie ist nicht möglich, da die Reaktion irreversibel (= nicht umkehrbar) ist.
2. Die Sekundärbatterie wird auch als Akkumulator (kurz auch „Akku“) bezeichnet. Im Gegensatz zur Primärbatterie, ist die Sekundärbatterie wiederaufladbar (engl.: „rechargeable“). Auch sie speichert die elektrische Energie auf elektrochemischer Basis und beim Entladevorgang wird die gespeicherte Energie wiederum in elektrische umgewandelt. Dieser Vorgang ist also reversibel (= umkehrbar).
3. Bei der Brennstoffzelle handelt es sich um eine sogenannte Tertiärzelle. Dies sind galvanische Zellen, bei denen der chemische Energieträger nicht lokal, sondern extern durchgehend zur Verfügung gestellt wird. Dies garantiert eine zeitlich unlimitierte und durchgehende Benützung.
Aufbau:
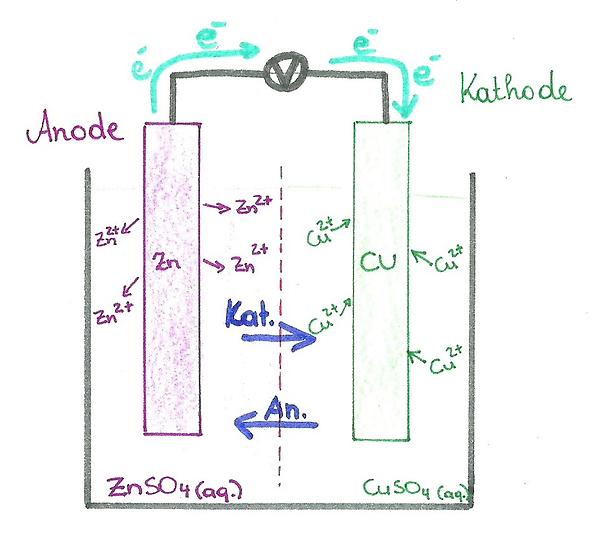
#
Eine Galvanische Zelle besteht aus 2 Halbzellen (=Metalle) und einem Elektrolyten. Die positiv geladene Halbzelle ist die Kathode (=edleres Metall), die negativ geladene Halbzelle ist die Anode (=unedleres Metall). Beide Halbzellen befinden sich in einem Elektrolyten (= Flüssigkeit, durch die Ionen von A nach B bzw. von B nach A wandern) und sind durch eine Membran voneinander getrennt. Dabei handelt es sich um eine semipermeable Membran (= halbdurchlässige), die keine Stoffe, jedoch Ionen durchlässt. Die positiv geladenen Ionen nennt man Kationen, die negativen Anionen.
Entladevorgang:
#
Legt man eine Spannung an die Galvanische Zelle an (Siehe Abb.1), so wandern die Elektronen von dem unedleren Metall zu dem edleren Metall. Damit es zu einem erneuten Ladevorgang kommen kann, muss es sich um einen geschlossenen Kreislauf handeln und die Reaktion muss reversibel sein (im Fall der Sekundärbatterie). Deshalb fließen beim Entladevorgang die Ionen durch den Elektrolyten (= Ionenstrom) und bilden einen Ausgleich zum Elektronenfluss. Somit ist der Kreislauf geschlossen.
Abb.1: Die beiden Metalle befinden sich in einem Elektrolyten und sind durch eine Membran voneinander getrennt. Wird eine Spannung angelegt, fließen die Elektronen (e-) von der Anode (Zn) über den Verbraucher (V) zur Kathode (Cu). Durch die Membran findet der Ionenaustaustausch statt.Entwicklungsgeschichte der Batterien:
#
o Im Jahre 1600 begannen erstmals Forschungen im Bereich der elektro-chemischen Energiespeicherungsmethoden durch den englischen Arzt und Physiker William Gilbert.
o 1791 entdeckte Galvani, ein italienischer Arzt, Anatom und Biophysiker, die Elektrizität bei Tieren durch Experimente mit Froschschenkeln.
1800 erfand der italienische Physiker Volta die Voltasche Säule, welche auch Volta-Element genannt wird und ein Vorläufer der heutigen Batterie ist. Es besteht aus mehreren übereinandergeschichteten Elementen, wovon jedes aus einer Elektrolytschicht, einer Kupfer- und Zinkfolie zusammengesetzt ist. Da man bei einer Reihenschaltung von Spannungsquellen die Spannungen addieren kann, sind viele Elemente aufeinander gestapelt, um eine möglichst hohe Gesamtspannung zu erzielen.
o 1802 wurde dank Cruickshank (EN) die elektrische Batterie für die Masse zugänglich.
o 1820 entdeckte Ampère (FR) die Elektrizität durch Magnetfelder.
o 1833 gab Faraday (EN) die nach ihm benannten Faraday’schen Gesetze bekannt.
o 1859 wurde die Säure-Blei-Batterie durch Plantè (FR) erfunden.
o 1899 innovierte Jungner (SWE) die Batterie (Nickel-Kadmium-Batterie), jedoch gelang erst 1947 durch Neumann (FR) die erfolgreiche Versiegelung dieser Batterie.
o 1901 entwarf Edison (USA) das Konzept der Nickel-Metall-Batterie.
o 1992 kommerzialisierte Kordesch (CAN) die wiederverwendbaren Alkalinbatterien und 1999 das Lithium-Ion-Polymer.
o 2002 begann die begrenzte Herstellung von Brennstoff-Zellen (PEM).
Recherche#
- Quelle 1: Chemie-/Physikunterricht in der Schule
- Quelle 2: Frühauf, Tegen u.a.: Treffpunkt Chemie. 3. Auflage, Dorner, Wien 2007.
- Quelle 3: Dvorak, K.; Schmut, W.; Schmut, K.: Rundum Chemie1. Oberstufe, Dorner, Wien 2006.
- Quelle 4: Dvorak, K.; Schmut, W.; Schmut, K.: Rundum Chemie2. Oberstufe. 2. Auflage, Dorner, Wien 2008.
- Siehe auch: Norwegens Speicherseen- Batterien für Europa?