Osteoporose
| Klassifikation nach ICD-10 | |
|---|---|
| M80.- | Osteoporose mit pathologischer Fraktur (manifeste Osteoporose) |
| M81.- | Osteoporose ohne pathologische Fraktur |
| M82.- | Osteoporose bei anderenorts klassifizierten Krankheiten |
| ICD-10 online (WHO-Version 2019) | |
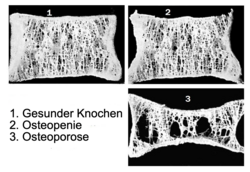
Die Osteoporose (von altgriechisch ὀστέον ostéon, deutsch ‚Knochen‘ und πόρος poros ‚Pore‘) ist eine Störung im Knochenstoffwechsel und eine häufige Alterserkrankung des Knochens, die ihn dünner und poröser und somit anfällig für Brüche (Frakturen) macht.
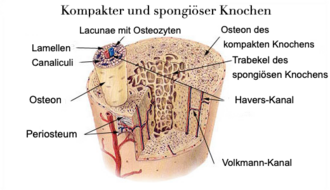
Die auch als Knochenschwund bezeichnete Krankheit ist gekennzeichnet durch eine Abnahme der Knochendichte infolge eines den Aufbau übersteigenden Abbaus von Knochengewebe im Rahmen des natürlichen Knochenumbaus. Aufgrund der höheren Umsatzrate ist die Spongiosa typischerweise stärker betroffen als die Kortikalis, was sich in den Prädilektionsstellen für Knochenbrüche niederschlägt; die erhöhte Frakturanfälligkeit kann allerdings das ganze Skelett betreffen.
Die Osteoporose, welche erstmals 1885 von dem Innsbrucker Pathologen Gustav Adolf Pommer (1851–1935) beschrieben wurde,[1] ist die häufigste Knochenerkrankung im höheren Lebensalter. Die Prävalenz einer manifesten Osteoporose beträgt in Deutschland circa 6 %[2]. Rund 80 Prozent aller Osteoporosen betreffen Frauen nach der Menopause (siehe Postmenopause), wobei vor allem kleinknochige Nordeuropäerinnen und Raucherinnen betroffen sind.
Typische Merkmale der Osteoporose sind eine Abnahme der Knochenmasse und Verschlechterung der Knochenarchitektur sowie als deren Folge eine Abnahme der Knochenstabilität. Dies führt zu einer erhöhten Gefahr von Knochendeformationen (Fischwirbel) und Knochenbrüchen. Knochenbrüche bei Osteoporose finden sich insbesondere an den Wirbeln, am Oberschenkelhals und am Handgelenk.
Krankheitsbild und -verlauf
Die primäre Osteoporose ist eine zunächst unmerklich verlaufende Erkrankung, die aber im Fall von Knochenbrüchen, insbesondere bei alten Menschen, eine hohe Krankheitsbelastung (Schmerzen, Bettlägerigkeit, manchmal dauerhafte Immobilisierung) bedeutet. Die Knochenmasse nimmt etwa in den ersten drei Lebensjahrzehnten zu (in der Jugend wird Knochen aufgebaut), erreicht dann einen Höhepunkt und fällt in den späteren Lebensjahren langsam wieder ab (Involutionsosteoporose bzw. Senile Osteoporose = Typ I[3]). Ein besonderes Risiko besteht für Frauen postmenopausal (Typ-I-Osteoporose). Man geht davon aus, dass in Europa etwa 30 % aller Frauen nach dem Klimakterium an primärer Osteoporose erkranken.[2] Für Männer ist ab dem 70. Lebensjahr die Altersosteoporose ein ebenso häufiges Krankheitsbild. Innerhalb der deutschen Bevölkerung über 50 Jahren ist eine von vier Frauen und einer von 17 Männern betroffen.[4] Eine Osteoporose aus sekundären Gründen ist eher selten, etwa in Folge von Stoffwechsel-Erkrankungen oder hormonellen Störungen, und tritt bei etwa 5 % aller Fälle auf. Sehr selten ist auch die Idiopathische juvenile Osteoporose junger Menschen.
Knochenbrüche infolge einer Osteoporose nach ihrer Häufigkeit:
- Wirbelkörper-Einbrüche (Sinterungen, Kompressionsfrakturen),
- Hüftgelenknahe Oberschenkelknochenbrüche (u. a. Schenkelhalsfrakturen),
- Handgelenknahe Speichenbrüche (distale Radiusfrakturen),
- Oberarmkopfbrüche (subcapitale Humerusfrakturen),
- Beckenbrüche (v. a. Sakrumfraktur)
Risikofaktoren
Neben den Grundrisikofaktoren Geschlecht und Alter sowie eventuellen Vorfrakturen sind eine Vielzahl an Risikofaktoren für das Auftreten einer Osteoporose bekannt:[5]
- Sekundäre Osteoporose (5 %):
- Verringerter Allgemeinzustand (frailty): Immobilisation (eingeschränkte Bewegung), Sturzneigung/Gleichgewichtsstörungen, etwa bei neurologischen Erkrankungen, wie Apoplex, Multiple Sklerose, Parkinson, Demenz, bei Hyponatriämie oder auch Depression
- Hormonell: Hyperkortisolismus (Cushing-Syndrom), (Männlicher) Hypogonadismus, Hyperparathyreoidismus, Hyperthyreose, Schwangerschaftsassoziierte Osteoporose, Wachstumshormonmangel bei Hypophyseninsuffizienz
- Gastroenterologische Ursachen: Malnutrition, Anorexia nervosa (Magersucht), Malabsorption, renale Osteopathie, exokrine Pankreasinsuffizienz (EPI)[6]
- Stoffwechselerkrankungen:
- Diabetes mellitus Typ 1
- Diabetes mellitus Typ 2 (in Abhängigkeit von der Krankheitsdauer)
- Cerebrotendinöse Xanthomatose[7][8]
- Medikamentös:
- Langzeittherapie mit Kortikosteroiden (Cortisol), insbesondere bei höheren Dosen (analog: Cushing-Syndrom) und v. a. bei oraler Einnahme (bei inhalativen und bei topisch angewendeten Präparaten ist der Effekt aufgrund der niedrigen kumulativen Dosis eher gering)
- Magensäure blockierende Medikamente (v. a. Protonenpumpenhemmer)[9]
- Sedativa: v. a. Benzodiazepine, auch höher dosierte Opioide
- Aromatasehemmer, insbesondere bei postmenopausalen Frauen
- Langzeittherapie mit Heparin (zur Hemmung der Blutgerinnung)
- Vitamin-K-Antagonisten als Antikoagulanzien wie Phenprocoumon (Marcumar) vermindern die Knochendichte, da Vitamin K für die Reifung der Knochenmatrix notwendig ist.[10]
- Hochdosierte Therapie mit Schilddrüsenhormonen vermindert die Knochendichte ebenso wie eine Hyperthyreose.
- Gonadotropin-Releasing-Hormon-Antagonisten bei Einnahme von über einem Jahr Dauer, hemmen fast vollständig die Östrogenbildung in den Ovarien.
- Hormonablative Therapie beim Mann (siehe auch: Hypogonadismus).
- Zytostatika
- Laxanzienabusus und Langzeittherapie mit Cholestyramin reduzieren die Resorption von Vitamin D im Verdauungstrakt.
- Lithium kann zu erhöhten Parathormonspiegeln führen und damit eine Osteoporose auslösen.
- Unter langfristiger Einnahme von Antikonvulsiva wurden Fälle von Osteoporose bis hin zu Frakturen berichtet. Das Bundesinstitut für Arzneimittel und Medizinprodukte hat entsprechend die Fachinformationen bestimmter Arzneimittel überarbeiten lassen.[11]
- Hereditär: Osteogenesis imperfecta, Hypophosphatasie, Ehlers-Danlos-Syndrom, Marfan-Syndrom, Homocystinurie, Geroderma osteodysplastica, Snyder-Robinson-Syndrom, Klinefelter-Syndrom
- Neoplastische Erkrankungen:
- Monoklonale Gammopathien (u. a. eine Monoklonale Gammopathie unklarer Signifikanz oder ein Multiples Myelom)
- Myeloproliferative Erkrankungen
- Rheumatologische/Immunologische Erkrankungen:
- Rheumatoide Arthritis
- Spondylitis ankylosans
- Chronisch-entzündliche Darmerkrankungen: Morbus Crohn, Colitis ulcerosa
- Zöliakie
- Systemischer Lupus Erythematodes
- Osteoporose kann als Symptom eines Mastzellaktivierungssyndroms (MCAS) auftreten.[12]
- Mastozytose
- Andere Ursachen:
- Perniziöse Anämie, Vitamin-B12-Mangel, Folsäuremangel, hoher Homozysteinspiegel
- Untergewicht
- hoher Alkoholkonsum (>50 g/d) und das Vorliegen einer alkoholischen Leberzirrhose
- Rauchen, COPD
- Fortgeschrittene Niereninsuffizienz (CKD Stadium III – V)
- Fleischreiche, gemüse-/obstarme Ernährung scheint ungünstig zu sein. Es wurde unter anderem ein Zusammenhang des Knochenstoffwechsels mit dem Säure-Basen-Haushalt vermutet, der sich jedoch nicht bewahrheitet hat.[13]
- Bariatrische Operation (B-II-Magenresektion oder Gastrektomie)
- Konsum von phosphathaltigen Colagetränken könnte ein Risiko darstellen, allerdings korreliert starker Colakonsum mit einer kalziumarmen Ernährung.[14]
- Eine genetische Komponente ist anzunehmen, da eine proximale Femurfraktur eines Elternteils das Risiko für das Vorliegen einer Osteoporose signifikant steigert.
Diagnostik
Eine weiterführende Diagnostik sollte insbesondere dann erfolgen, wenn Knochenbrüche auftreten, die nicht durch den Unfallmechanismus erklärbar sind bzw. wenn gar kein Verletzungsereignis stattgefunden hat (inadäquates Trauma), oder wenn entsprechende Risikokonstellationen, welche das Vorliegen einer Osteoporose begünstigen, vorliegen.[15]
Anamnese
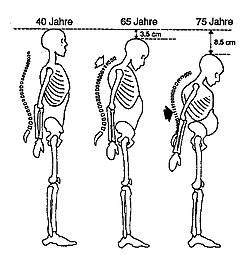
Im Rahmen der Anamnese sind eventuell vorbekannte Frakturen zu erheben.[5] Patienten mit einer primären Osteoporose berichten häufig über eine Abnahme der Körpergröße, welche durch die stattgehabte Sinterung der Wirbelkörper sowie die Ausbildung einer Kyphose oder Skoliose der Wirbelsäule zu erklären ist. In der Vorgeschichte können osteoporose-typische Frakturen, zum Beispiel an der Wirbelsäule, des Oberschenkelhalses oder des distalen Radius erfragt werden. Hinzu kommt die Erfassung der Risikofaktoren für Osteoporose, etwa ein reduzierter Allgemeinzustand, wenig Bewegung, wenig Sonnenlicht, kalziumarme Ernährung, eine frühe Menopause und familiäre Belastungen sowie Hinweise auf andere systemische Knochenerkrankungen.
Akut aufgetretene Schmerzen, insbesondere nach einem nur leichten Trauma oder sogar spontan aufgetreten, können bei der entsprechenden Vorgeschichte den Verdacht auf eine osteoporotische Fraktur geben.
Klinische Untersuchung
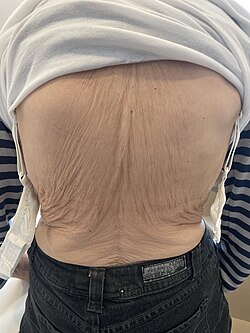
Im Rahmen der klinischen Untersuchung erfolgen die Messung der Körpergröße (Vergleich zu früheren Ergebnissen oder Angaben), die Feststellung einer Kyphose der Brustwirbelsäule beziehungsweise einer Skoliose der Lendenwirbelsäule, typische Hautfalten am Rücken („Tannenbaum-Phänomen“) und eine Verringerung des Abstands von Rippenbogen und Beckenkamm.
Bei dem Verdacht auf eine akute Fraktur werden die entsprechenden Körperregionen nach den allgemeinen Frakturzeichen näher untersucht. Bei dem Verdacht auf eine Fraktur der Brust- oder der Lendenwirbelsäule wird der Rücken leicht abgeklopft. Eine Fraktur des Schenkelhalses oder des Unterarmes kann meist schon klinisch durch eine entsprechende Fehlstellung vermutet werden.
Radiologische Untersuchung
Osteoporotische Frakturen sind in der Regel mittels einer Röntgenuntersuchung feststellbar. Insbesondere im Bereich der Brust- und der Lendenwirbelsäule können weitere bildgebende Verfahren angewendet werden. Hierzu zählt das CT, welches eine genaue Auswertung der Frakturmorphologie ermöglicht, sowie das MRT, welches etwa in Hinblick auf die Frage, ob eine Fraktur frisch oder älter ist, weiteren Aufschluss geben kann. Zur Bestimmung der Knochendichte erfolgt in der Regel eine DEXA-Messung an der Lendenwirbelsäule sowie an beiden Schenkelhälsen.[16] Nur wenn dieses Verfahren keine eindeutige Aussage erlaubt, kommen andere Verfahren zur Anwendung.[16] Die Knochendichte selbst ist jedoch nur zum Teil für das erhöhte Bruchrisiko der Knochen bei Osteoporose verantwortlich; die Bruchfestigkeit wird im Wesentlichen von der äußeren Compacta-Schicht bestimmt, während die Knochendichtemessung vor allem auch den trabekulären Knochen misst.[17]
Knochendichtemessung
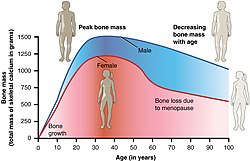

Unter der Knochendichte (auch Knochenmineraldichte, englisch Bone density, bone mineral density (BMD)) versteht man das Verhältnis der mineralisierten Knochensubstanz zu einem definierten Knochenvolumen.
Mit der Knochendichtemessung (Osteodensitometrie) wird der sogenannte T-Wert ermittelt. Dies ist ein statistischer Wert, der einen Vergleich des gemessenen Knochendichtewertes mit der Population junger erwachsener Frauen und eine Aussage zum Bruchrisiko ermöglicht:
- Ein T-Score von ≥ −1 gilt als normal.
- Ein T-Score zwischen −1 und −2,5 spricht für das Vorliegen einer Vorstufe der Osteoporose vor, der Osteopenie.
- Ein T-Score von < −2,5 bedeutet: Diagnose Osteoporose.Ergänzend wird der Z-Wert angegeben, welcher einen Vergleich mit der entsprechenden Altersgruppe ermöglicht; ein Wert von >−1) gilt wiederum als normal.
Zur Messung der Knochendichte (BMD – englisch bone mineral density) stehen verschiedene Verfahren zur Verfügung:
Am weitesten verbreitet ist die Dual-Röntgen-Absorptiometrie (DXA oder DEXA – engl. dual-energy-x-ray-absorptiometry), auf welcher die Definition der WHO basiert. Eine weitere – jedoch strahlenintensive – Methode stellt die quantitative Computertomographie (QCT bzw. pQCT) dar. Die Messung der Knochendichte mittels Ultraschalls, also mit dem sogenannten quantitativen Ultraschall (QUS), ist umstritten, da sie nur in wenigen Fällen aussagekräftig ist. Die Aussagekraft für DXA und QCT ist hingegen gut belegt.
Die Messung der Knochendichte zur Früherkennung (Screening) ist keine Leistung der gesetzlichen Kassen. Der Versicherte muss sie selbst bezahlen, wenn vor der Messung kein Knochenbruch ohne entsprechende Krafteinwirkung (ein sogenannter Ermüdungsbruch) mit Verdacht auf Osteoporose vorliegt.
Ausgehend von einer Knochendichtemessung kann über den computerbasierten Algorithmus FRAX (WHO Fracture Risk Assessment Tool) die Wahrscheinlichkeit bestimmt werden, in den folgenden zehn Jahren eine osteoporotische Fraktur zu erleiden. Dies ist besonders für die Abschätzung der Notwendigkeit einer antiresorptiven Therapie bei einer Osteopenie geeignet.[18]
Zu beachten sind besonders beim älteren Menschen häufige Fehlerquellen bei der DXA-Messung an der Lendenwirbelsäule mit Verschleierung einer verminderten oder sogar Vortäuschung einer höheren Knochendichte: durch Sinterung von Wirbelkörpern, Skoliose, Spondylophyten oder Arterienverkalkung (Aortosklerose). Für ein verwertbares Ergebnis müssen wenigstens zwei Wirbelkörper beurteilbar sein.[19]
Wenn bereits osteoporotische Frakturen im Röntgenbild nachgewiesen wurden oder eine pertrochantäre Femurfraktur aufgetreten ist, kann auch ohne vorherige DXA-Messung die Diagnose einer Osteoporose gestellt und eine adäquate Therapie eingeleitet werden.[19]
Laborchemische Untersuchungen
Bei Verdacht auf das Vorliegen einer Osteoporose empfiehlt die AWMF-Leitlinie die Durchführung eines Basislabors zum Ausschluss einer sekundären Genese. Zudem sind bei der Einleitung einer spezifischen antiosteoporotischen Therapie Blutwerte, z. B. hinsichtlich der Nierenfunktion, zu beachten. Die Werte des Basislabor lauten: Kleines Blutbild, Elektrolyte (Calcium, Phosphat, Natrium), Alkalische Phosphatase, Gamma-GT, Kreatinin-Clearance (GFR), TSH, CRP, BSG und Eiweißelektrophorese. Je nach Befund können – beispielsweise bei Verdacht auf ein Plasmozytom – weitere Untersuchungen notwendig werden. Die Bestimmung von Vitamin D wird nur in ausgewählten Fällen durchgeführt. Bei Männern mit Verdacht auf Hypogonadismus kann der Testoteron-Spiegel ermittelt werden.
Es wurden diverse Biomarker entwickelt, welche frühzeitig eine Osteoporose anzeigen sollen. Diese Untersuchungen sind jedoch nicht als routinemäßiger Bestandteil der Osteoporose-Diagnostik anzusehen.[16]
Differentialdiagnose
Andere Erkrankungen, die primär mit einer verschlechterten Knochenqualität einhergehen, sind:
- die Osteomalazie
- die Hypophosphatasie (HPP). Diese tritt seltener auf als die Osteoporose. Manche Formen der Hypophosphatasie werden erst im Erwachsenenalter symptomatisch und könnten zur Fehldiagnose einer Osteoporose führen.[20] Eine erniedrigte Aktivität der alkalischen Phosphatase im Serum sowie ein früher Milchzahn-Verlust und das Auftreten atypischer Frakturen (z. B. subtrochantäre laterale Femurfraktur) mit verzögerter Frakturheilung weisen auf eine HPP hin.[20] Die Unterscheidung zwischen der Osteoporose und der HPP ist wichtig, da bei der HPP die Gabe von Bisphosphonaten kontraindiziert ist.[20]
- die Renale Osteopathie
Behandlungsmöglichkeiten und Prävention
Lebensweise
Körperliche Aktivität schützt vor Knochenschwund. Die Kräfte, die dabei auf den Knochen wirken, regen die knochenaufbauenden Zellen an, neue Knochensubstanz zu bilden. Empfohlen werden dabei vorwiegend gewichttragende Ausdauerübungen und muskelaufbauendes Training.[21][22] Insbesondere bei älteren Patienten ist Physiotherapie wichtig, um Stürze und Frakturen zu vermeiden. Daneben fördert ausreichende Sonnenlichtexposition die Vitamin-D-Produktion der Haut. Hier wird mindestens eine halbe Stunde täglich empfohlen.
Ernährung
Evidenzbasierte Empfehlungen
Der DVO empfiehlt als Basistherapie für Osteoporosepatienten eine Zufuhr von 1000 mg Calcium und 800–1000 IE Vitamin D pro Tag mit der Nahrung.[23] Wenn die empfohlene Zufuhr von Calcium mit ausgewogener Ernährung dennoch nicht erreicht werden sollte, kann eine Supplementierung, etwa in Tablettenform, durchgeführt werden. Als Bestandteil der Basistherapie empfehlen die internationalen Leitlinien die kombinierte Einnahme mit Vitamin D (Ergo- und Cholecalciferol, nicht aber Metabolite wie 1-alpha- oder 1,25-Dihydroxy-Vitamin D). Zudem ist eine eiweißarme Kost zu vermeiden.[23]
Starker Alkohol- und Tabakkonsum sollte vermieden werden.[23] Außerdem sollte, aufgrund des hohen Phosphatgehaltes, auf den Konsum von Softdrinks verzichtet werden.[24]
Obwohl Vitamin K bei der Reifung der Knochenmatrix benötigt wird und bei langfristiger Einnahme von Vitamin-K-Antagonisten wie Marcumar das Osteoporoserisiko steigt, gibt es keinen Hinweis darauf, dass die Einnahme von Vitamin K einen positiven Effekt hat. Diesbezüglich existiert auch keine qualitative Studie. Während in sämtlichen evidenzbasierten Richtlinien die Einnahme von Vitamin D und Kalzium empfohlen wird, gibt es keine Empfehlung zur Vitamin-K-Einnahme.[25][26]
Alternativmedizinische Empfehlungen
Eine Empfehlung, die jedoch weder wissenschaftlich abgesichert noch in den Leitlinien genannt wird, ist die der sogenannten basischen Ernährung oder der Einnahme von sogenannten Basensalzmischungen. Eine vermeintliche Übersäuerung des Körpers soll nach Angaben von Anhängern dieser Behandlungsmethode zu verstärktem Knochenschwund führen, da zur Neutralisation der Säure basische Calciumsalze (deren Existenz wissenschaftlich unbestritten ist) aus dem Knochengewebe gelöst würden (wie der Kalk aus einer Eierschale im Essigbad).[27] Bei dieser Theorie werden allerdings die weitaus bedeutenderen Puffersysteme der Blutpuffer vernachlässigt. Für eine Wirkung der Diäten fehlt jeder Nachweis. Die Deutsche Gesellschaft für Ernährung rät von einem vollständigen Verzicht auf „säurebildende Lebensmittel“ ab.[28]
Pharmakotherapie
Für die Indikation einer spezifischen Pharmakotherapie gibt es verschiedene Leitlinien/Algorithmen, wo das Lebensalter und das Geschlecht, die Knochendichte, stattgehabte Frakturen und weitere Risikofaktoren (siehe oben) einbezogen werden. Generell kann zwischen einer antiresorptiven (Medikamente, welche den Knochenabbau hemmen) und einer osteoanabolen (Medikamente, welche den Knochenaufbau fördern) Therapie unterschieden werden. In der aktuellen Leitlinie der DVO (2023) wird bei erhöhtem Frakturrisiko (>3 % in den kommenden 3 Jahren) der Beginn mit einer Bisphosphonat-Therapie empfohlen.[26] Bei deutlich erhöhtem Risiko (>10 % in den kommenden 3 Jahren) und bei speziellen Konstellationen, z. B. bei langjähriger Glukokortikoid-Therapie, wird direkt der Beginn mit einer osteoanabolen Medikation empfohlen.[26] Es gilt zu beachten, dass im Anschluss an eine osteoanabole Medikation eine antiresorptive Therapie durchgeführt werden soll, da sonst das Risiko für einen Rebound, d. h. für einen raschen Wiederabfall der Knochendichte besteht.[26]
Gängige Präparate aus der Gruppe der Bisphosphonate sind: Alendronsäure, Ibandronsäure, Risedronsäure und Zoledronsäure. Sie unterscheiden sich in der Applikation (oral/intravenös) und in der Dosis, weshalb das Einnahmeintervall variiert. Bei oral eingenommenen Bisphosphonaten besteht das Risiko für ein Reflux und somit eine Schädigung der Speiseröhre. Aus diesem Grund sollten sie vor dem Frühstück eingenommen werden und es sollte anschließend für circa eine halbe Stunde eine aufrechte Haltung eingehalten werden. Intravenöse Präparate haben dieses Risiko nicht, sind jedoch in der Regel höher dosiert und haben entsprechend ein höheres Risiko für das Auftreten von Knochennekrosen des Kiefers, da sich dessen Knochen generell schneller erneuert als andere. Aus diesem Grund wird vor Beginn der Therapie eine zahnärztliche Vorstellung empfohlen. Das Risiko für Knochennekrosen besteht auch für Denosumab (Handelsname: Prolia). Dieses Medikament wird halbjährlich als Spritze unter die Haut verabreicht.
Eine weitere antiresorptive Medikamentengruppe stellen die Selektiven Östrogen-Rezeptor-Modulatoren (SERM), wie Raloxifen, dar, welche jedoch nur in ausgewählten Fällen zum Einsatz kommen.
An osteoanabolen Medikamenten werden zwei verschiedene Medikamentengruppen eingesetzt:
- Parathormon und Analoga, wie Teriparatid oder Abaloparatid
- Romosozumab, ein monoklonaler Antikörper
Bei postmenopausalen Frauen sind zudem Östrogene (Hormonersatztherapie) zur Prävention einer Osteoporose zugelassen, wenn eine Unverträglichkeit oder eine Kontraindikation hinsichtlich anderer Arzneimittel besteht.[29] Auch die externe Anwendung von Östrogencreme (auf der Haut) soll die Knochensubstanz stärken und den Knochenmasseverlust bremsen, bevor es zu Brüchen kommen kann.[30][31]
Weitere Präparate, die aber nur in seltenen Fällen bzw. nicht mehr eingesetzt werden, lauten:
- Calcitonin, kaum noch verwendet, der Nutzen ist schlecht belegt. Außerdem kommt es meistens zu schweren Allergiesymptomen bei der Behandlung.
- STH (Wachstumshormon), kein Nutzen belegt; evtl. problematische Nebenwirkungen.
- Fluoride (veraltet; entwickeln harte, aber spröde Knochen, die Stabilität wird nicht besser)
- Strontiumranelat (nicht mehr im deutschsprachigen Raum verfügbar)
- Vitamin-D-Metabolite wie 1-alpha- oder 1,25-Dihydroxy-Vitamin D (Nutzen bei postmenopausaler Osteoporose nicht eindeutig belegt, teuer, problematische Nebenwirkungen; 1,25-Vitamin D (Calcitriol) ist wirksam und indiziert bei bestimmten Knochenerkrankungen im Rahmen fortgeschrittener Nierenerkrankungen).
- Die tägliche Anwendung einer nitroglycerinhaltigen Salbe erhöhte in einer Studie kanadischer Forscher die Knochendichte deutlich. Dass dadurch das Risiko von Knochenbrüchen verringert wird, wird jedoch nicht belegt. Die Wirkung wird mit der Freisetzung von Stickoxid erklärt, welches die Osteoklasten direkt hemmt.[32]
Zur Überwachung einer Osteoporose-Therapie sollten regelmäßige Kontrollen (siehe oben) durchgeführt werden. Im Labor sollte auf mögliche Nebenwirkungen und mögliche Kontraindikationen für die jeweilige Therapie geachtet werden.[26] So sind viele Osteoporose-Medikamente bei einer fortgeschrittenen Niereninsuffizienz nicht zugelassen.[33] Zum Monitoring können auch laborchemische Knochenmarker, wie β-CrossLaps, eingesetzt werden. Es empfiehlt sich ferner auch eine Verlaufmessung der Knochendichte; eine Zunahme der Dichte im Verlauf einer spezifischen Therapie ist generell mit einer Reduktion des Risikos für das Auftreten (weiterer) Frakturen verbunden.[16] Dass eine Erhöhung der Knochendichte aber nicht unbedingt mit einem verminderten Knochenbruchrisiko einhergehen muss, sondern es sogar erhöhen kann, zeigt das Beispiel der Fluoride, die das Bruchrisiko erhöhen können (Fluorose). Daher ist es unerlässlich, für neue Osteoporose-Mittel Studien durchzuführen, die eine Verminderung des Bruchrisikos nachweisen und die dabei auch den bereits bekannten Mitteln in ihrer Wirksamkeit nicht unterlegen sein dürfen.
Verhinderung von Brüchen
Medikamente, welche das Sturz- bzw. Osteoporose-Risiko erhöhen, sollten – sofern möglich – in der Dosis reduziert oder ganz abgesetzt werden.[23] Zudem sind ggfs. Sehhilfen anzupassen und Symptome, wie (nächtliches) Wasserlassen/Inkontinenz oder Schlafstörungen, entsprechend zu therapieren.[23]
Hüftprotektoren
Um osteoporotischen Oberschenkelhalsfrakturen vorzubeugen, werden Hüftprotektoren eingesetzt. Ein Cochrane-Review von 2014 kam zu dem Ergebnis, dass Hüftprotektoren das Risiko von Oberschenkelhalsfrakturen bei älteren Menschen reduzieren können.[34] Die geringe Akzeptanz und Nutzung der Protektoren schränkt ihren prophylaktischen Wert jedoch ein.[35]
Zur Vorbeugung bzw. unterstützenden Behandlung der Osteoporose gibt es auch verschiedene Verfahren der alternativen Medizin. Die Behandlungskosten dieser Verfahren werden jedoch nicht von den gesetzlichen Krankenversicherungen gedeckt.
Physikalische Verfahren
- Magnetfeldtherapie: pulsierende elektromagnetische Felder sollen den Knochenaufbau stimulieren.[36]
- Vibrationstraining – auch biomechanische Stimulation (BMS): sie wurde ursprünglich zur Behandlung von russischen Kosmonauten entwickelt: Die zu behandelnde Person steht auf einer Platte, die in einem Frequenzbereich von 20 bis etwa 50 Hz vibriert und durch den Dehnreflex Muskelkontraktionen hervorruft. Die dabei auftretenden Kräfte sollen den Knochen zum Wachstum stimulieren (Mechanostat). Im Tiermodell konnte dieser Effekt auch belegt werden, beim Menschen ist der Nutzen aber uneindeutig.[37]
Wirtschaftliche Aspekte
Mit jährlich etwa 2,5 bis 3 Milliarden Euro an direkten und indirekten Krankheitskosten in Deutschland hat die Osteoporose auch ein großes volkswirtschaftliches Gewicht. Deshalb wurde sie von der Weltgesundheitsorganisation (WHO) auf die Liste der zehn wichtigsten Erkrankungen gesetzt.
Von Kritikern wird angeführt, dass die Neubewertung der Osteoporose in den 1990er Jahren durch die Pharmaindustrie und die Hersteller von Diagnostika gesteuert sei, die einen Absatzmarkt für neue diagnostische Geräte und Medikamente schaffen wollen (Disease Mongering).[38][39]
Siehe auch
- Transiente Osteoporose
- Expertenstandard Sturzprophylaxe in der professionellen Pflege
- Weltosteoporosetag
Literatur
- Tara Coughlan, Frances Dockery: Osteoporosis and fracture risk in older people. In: Clin Med (Lond) 14, 2, 2014: 187–191. PMC 4953292 (freier Volltext).
- Adele L Boskey, Robert Coleman: Aging and bone. In: J Dent Res 89, 12, 2010: 1333–1348. PMC 2991386 (freier Volltext).
- Walter Siegenthaler, Hubert E. Blum: Klinische Pathophysiologie. 9., völlig neu bearbeitete Auflage. Georg Thieme Verlag, Stuttgart u. a. 2006, ISBN 3-13-449609-7.
- Beat Seiler: Gesundheitspolitisches Programm für eine angemessene Osteoporose-Versorgung. (= Schriftenreihe der SGGP. 85). Verlag Schweizerische Gesellschaft für Gesundheitspolitik SGGP, Zürich 2006, ISBN 3-85707-85-4.
Historische Literatur
- Lois Jovanovic, Genell J. Subak-Sharpe: Hormone. Das medizinische Handbuch für Frauen. (Originalausgabe: Hormones. The Woman’s Answerbook. Atheneum, New York 1987) Aus dem Amerikanischen von Margaret Auer, Kabel, Hamburg 1989, ISBN 3-8225-0100-X, S. 214–222 und 383.
- Ludwig Weissbecker: Störungen im Knochenstoffwechsel. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 1123–1129, hier: S. 1126 f. (Die Osteoporose).
Weblinks
Organisationen
- Wissenschaftlicher Dachverband Osteologie (DVO) / S3-Leitlinie für Osteoporose
- www.osteoporose.org – Kuratorium Knochengesundheit
- www.netzwerk-osteoporose.de (NWO)– Netzwerk-Osteoporose – gemeinnützige Organisation für Patientenkompetenz e. V. zur bundesweiten Förderung von Selbsthilfe, Rehabilitationssport, Funktionstraining und der Organisationsstrukturen in der Osteoporoseselbsthilfe.
- Osteoporose Selbsthilfegruppen Dachverband e. V.
- International Osteoporosis Foundation
- Deutsche Rheuma-Liga
Informationen
- S3-Leitlinie Prophylaxe, Diagnostik und Therapie der Osteoporose der Deutschsprachigen Wissenschaftlichen Osteologischen Gesellschaften (Dachverband der Deutschsprachigen Wissenschaftlichen Osteologischen Gesellschaften e. V.). In: AWMF online (Stand September 2023)
- Leitlinie Osteoporose 2017. Dachverband Osteologie, 26. Januar 2018.
- Leitlinie Osteoporose 2014. (historisch). Dachverband Osteologie, 13. November 2014, archiviert vom (nicht mehr online verfügbar) am 25. Februar 2018.
- Erika Baum, Klaus M. Peters: Primäre Osteoporose – leitliniengerechte Diagnostik und Therapie. In: Dtsch Arztebl. Nr. 105(33), 2008, S. 573–582 (Übersichtsarbeit).
Einzelnachweise
- ↑ Horst Kremling: Historische Betrachtungen zur präventiven Heilkunde. In: Würzburger medizinhistorische Mitteilungen. Band 24, 2005, S. 244.
- 1 2 3. Prävalenz und Inzidenz der Osteoporose und ihrer Folgen, sozioökonomische Relevanz | DVO Leitlinie Osteoporose 2023. Abgerufen am 23. Juli 2024 (deutsch).
- ↑ Vgl. H. Jesserer, W. Kirchmayr: Die präsenile und die senile Involutionsosteoporose (= Acta rheumatologica. Nr. 8). Geigy, Basel (November) 1955.
- ↑ P. Hadji, S. Klein, H. Gothe et al.: Epidemiologie der Osteoporose – Bone Evaluation Study. Eine Analyse von Krankenkassen-Routinedaten. Deutsches Ärzteblatt, doi:10.3238/arztebl.2013.0052, abgerufen am 5. September 2023
- 1 2 4. Risikofaktoren für vertebrale und Schenkelhalsfrakturen | DVO Leitlinie Osteoporose 2023. Abgerufen am 23. Juli 2024 (deutsch).
- ↑ Simon Sirtl et al.: Die Pankreatitis – und sie bewegt sich doch: ein Leitlinien-Update. In: Kompendium Gastroenterologie, 2022, Seite 44–51
- ↑ Berginer et al.: Chronic Diarrhea and Juvenile Cataracts: Think Cerebrotendinous Xanthomatosis and Treat. In: Pediatrics. Nr. 123(1):143-7, 2009, doi:10.1542/peds.2008-0192 (aappublications.org).
- ↑ Mignarri et al.: A suspicion index for early diagnosis and treatment of cerebrotendinous xanthomatosis. In: J Inherit Metab Dis. Nr. 37(3):421-9, 2014, doi:10.1007/s10545-013-9674-3 (wiley.com).
- ↑ Mangel an Magensäure beeinflusst Kalzium-Aufnahme. ( vom 7. Mai 2010 im Internet Archive)
- ↑ Osteoporose-Selbsthilfegruppen-Dachverband: Vitamin K bei Osteoporose, abgerufen am 9. Januar 2024
- ↑ Antiepileptika und Knochenerkrankungen (PDF; 60 kB). Bekanntmachung des BfArM vom 9. Januar 2013.
- ↑ Lawrence B Afrin, Joseph H Butterfield, Martin Raithel, Gerhard J Molderings: Characterization of Mast Cell Activation Syndrome. In: Often seen, rarely recognized: mast cell activation disease--a guide to diagnosis and therapeutic options. Band 48, Nr. 3, 2016, S. 190–201, doi:10.3109/07853890.2016.1161231, PMID 27012973 (englisch).
- ↑ A. Prentice: Diet, nutrition and the prevention of osteoporosis. In: Public Health Nutrition. 2004 (7), S. 227–243.
- ↑ K. L. Tucker u. a.: Framingham Osteoporosis Study: Colas, but not other carbonated beverages, are associated with low bone mineral density in older women. ( vom 29. April 2008 im Internet Archive)In: American Journal of Clinical Nutrition. 2006 (84), S. 936–942.
- ↑ 8. Basisdiagnostik | DVO Leitlinie Osteoporose 2023. Abgerufen am 23. Juli 2024 (deutsch).
- 1 2 3 4 5. Spezifische messtechnische Einzelrisikofaktoren | DVO Leitlinie Osteoporose 2023. Abgerufen am 23. Juli 2024 (deutsch).
- ↑ G. Holzer u. a.: Hip fractures and the contribution of cortical versus trabecular bone to femoral neck strength. In: J Bone Miner Res. 24, 2009, S. 468–474. doi:10.1359/jbmr.081108
- ↑ A. Unnanuntana, B. P. Gladnick, E. Donnelly, J. M. Lane: The assessment of fracture risk. In: J Bone Joint Surg Am. 92-A, 2010, S. 743–753.
- 1 2 Walter Behringer, Joachim Zeeh: Diagnostik und Therapie der Osteoporose. In: Ärzteblatt Thüringen. 23, 2012, S. 275–276.
- 1 2 3 T. Schmidt, M. Amling, F. Barvencik: Hypophosphatasie. In: Der Internist. Band 57, Nr. 12, 28. Oktober 2016, ISSN 0020-9554, S. 1145–1154, doi:10.1007/s00108-016-0147-2.
- ↑ J. Body u. a.: Non-pharmacological management of osteoporosis: a consensus of the Belgian Bone Club. In: Osteoporos Int. Band 22, Nr. 11, 2011, S. 2769–2788, doi:10.1007/s00198-011-1545-x.
- ↑ D. Bonaiuti u. a.: Exercise for preventing and treating osteoporosis in postmenopausal women. In: Cochrane Database Syst Rev. Band 3, April 2002, doi:10.1002/14651858.CD000333 (englisch).
- 1 2 3 4 5 6. Generelle Osteoporose- und Frakturprophylaxe | DVO Leitlinie Osteoporose 2023. Abgerufen am 23. Juli 2024 (deutsch).
- ↑ J. D. Ringe (Hrsg.): 4.2 Allgemeine Möglichkeiten der Osteoporoseprävention. De Gruyter, 2019, ISBN 978-3-11-087951-3, doi:10.1515/9783110879513-toc/html (degruyter.com [abgerufen am 14. August 2021]).
- ↑ C. J. Rosen: Postmenopausal osteoporosis. In: New England Journal of Medicine. 353, 2005, S. 595–603.
- 1 2 3 4 5 9. Therapie | DVO Leitlinie Osteoporose 2023. Abgerufen am 24. Juli 2024 (deutsch).
- ↑ Wolfgang Bayer, Wolfgang Gerz: Säure-Basen-Haushalt und Osteoporose. In: Erfahrungsheilkunde. 55, 2006, S. 142–145, doi:10.1055/s-2006-932299.
- ↑ Darum sind viele Säure-Basen-Kuren Quatsch; quarks.de, abgerufen am 6. Mai 2023.
- ↑ siehe: S3 Leitlinie Peri- und Postmenopause-Diagnostik und Interventionen unter Federführung der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (AWMF-Registernummer 016-062)
- ↑ T. S. Yang, Y. J. Chen, W. H. Liang et al., (2007): A clinical trial of 3 doses of transdermal 17beta-estradiol for preventing postmenopausal bone loss: a preliminary study. J Chin Med Assoc. 2007 May;70(5):200-6. PMID 17524997 doi:10.1016/S1726-4901(09)70358-2
- ↑ H. J. Kim, Y. K. Oh, J. S. Lee et al., (2014): Effect of Transdermal Estrogen Therapy on Bone Mineral Density in Postmenopausal Korean Women. Journal of Menopausal Medicine 2014 Dec; 20(3): 111–117. PMID 25580422 doi:10.6118/jmm.2014.20.3.111
- ↑ Effect of Nitroglycerin Ointment on Bone Density and Strength in Postmenopausal Women: A Randomized Trial. In: Journal of the American Medical Association. 305(8), 2011, S. 800–807.
- ↑ Alexander Pfeil, Uwe Lange: Update DVO-Leitlinie 2023 „Prophylaxe, Diagnostik und Therapie der Osteoporose bei postmenopausalen Frauen und bei Männern ab dem 50. Lebensjahr“ – Was ist neu für die Rheumatologie? In: Zeitschrift für Rheumatologie. Band 83, Nr. 5, Juni 2024, ISSN 0340-1855, S. 401–406, doi:10.1007/s00393-024-01495-x, PMID 38512355, PMC 11147822 (freier Volltext) – (springer.com [abgerufen am 24. Juli 2024]).
- ↑ N. Santesso, A. Carrasco-Labra, R. Brignardello-Petersen: Hip protectors for preventing hip fractures in older people. In: The Cochrane database of systematic reviews. Band 3, 31. März 2014, doi:10.1002/14651858.CD001255.pub5, PMID 24687239.
- ↑ N. M. van Schoor, W. L. Devillé, L. M. Bouter, P. Lips, P. Lips: Acceptance and Compliance with External Hip Protectors: A Systematic Review of the Literature. In: Osteoporosis International. Band 13, 1. Dezember 2002, S. 917–924, doi:10.1007/s001980200128, PMID 12459933 (springer.com).
- ↑ Jiang, Feng; Xie, Xianping; Pang, Xianlun; Zheng, Li: Efficacy of magnetic therapy for osteoporotic patients: A meta-analysis of randomized controlled studies. In: Medicine. Band 103, Nr. 2, 12. Januar 2024, doi:10.1097/MD.0000000000036881, PMID 38215089.
- ↑ Anushree Singh, Anuj R. Varma: Whole-Body Vibration Therapy as a Modality for Treatment of Senile and Postmenopausal Osteoporosis: A Review Article. In: Cureus. Band 15, Nr. 1, 12. Januar 2023, doi:10.7759/cureus.33690, PMID 36793830, PMC 9925023 (freier Volltext).
- ↑ System ohne Steuerung. In: Der Spiegel. Nr. 44, 1999 (online).
- ↑ Die Abschaffung der Gesundheit. In: Der Spiegel. Nr. 33, 2003 (online).
License Information of Images on page#
| Image Description | Credit | Artist | License Name | File |
|---|---|---|---|---|
| Bone density peaks at about 30 yearsof age. Women lose bone mass more rapidly than men. | OpenStax College | Anatomy & Physiology, Connexions Web site. http://cnx.org/content/col11496/1.6/ , Jun 19, 2013. | Datei:615 Age and Bone Mass.jpg | |
| Histologische Darstellung | Eigenes Werk | Partynia modified File:Illu compact spongy bone.jpg by U.S. National Cancer Institute's Surveillance, Epidemiology and End Results (SEER) Program | Datei:Kompakter und spongiöser Knochen.png | |
| Schema des Körperhöhenverlusts bei Osteoporose | eigene Publikation | -- Karlarndthans 17:34, 8. Jun. 2010 (CEST) | Datei:Osteop.jpg | |
| Tannenbaum-Zeichen (German for “fir tree sign“, typical for en:Osteoporosis ). 75y female | Eigenes Werk | Smartbyte | Datei:Osteoporosis tannenbaum.jpg | |
| The Rod of Asclepius overlaid with a caution symbol | Star of life caution.svg with Nuvola apps important.svg | Gigillo83 | Datei:P medicine caution.svg | |
| Piktogramm zum Kennzeichnen von Informationen bei einer Wahl/Abstimmung. | Own illustration, 2007 | Arne Nordmann ( norro ) | Datei:Pictogram voting info.svg | |
| Bewertungsicon "Quelle" für Artikel mit fehlenden Quellen. | based on Image:Qsicon_Quelle.png and Image:QS icon template.svg | Hk kng , Image:Qsicon_Quelle.png is by User:San Jose , Image:QS icon template.svg is by User:JesperZedlitz | Datei:Qsicon Quelle.svg | |
| Datei:Wiktfavicon en.svg | ||||
| Entwicklungsstadien einer Osteoporose | Eigenes Werk German version of File:Vertebral osteoporosis.jpg by Δρ. Χαράλαμπος Γκούβας | Partynia | Datei:Wirbelkörper.png |



