COVID-19: Humanes 3D-Modell enthüllt neues Angriffsziel zur Verhinderung schwerer Verläufe#
Lungenepithelzellen setzen entzündungsfördernde Immunelemente frei#
Komplement-Blockade mit zugelassenem Medikament könnte schweren Verlauf abwenden#
Tierversuchsfreier Nachweis mit innovativen Zellkulturen#
Schwere Lungenschäden bei COVID-19 sind oft die Folge einer überschießenden Immunantwort. Einem interdisziplinären Team um die Innsbrucker ImmunologInnen Doris Wilflingseder und Wilfried Posch ist es gelungen, die entzündungsfördernden Komplement-Rezeptoren C3aR und C5aR als Treiber dieser folgenschweren Immunreaktion festzumachen. Die Blockade von Komplement bietet eine vielversprechende therapeutische Angriffsfläche für die Verhinderung eines schweren COVID-19-Verlaufs.
Innsbruck, am 20.05.2021: Das Komplementsystem ist Teil unseres angeborenen Immunsystems. Seine Zellen und Proteine haben eine wichtige Funktion für den Schutz des Körpers vor Viren und anderen Erregern, ehe sich T Zellen und Antikörper gebildet haben. Diese Akut-Phase der Wechselwirkung zwischen Erreger und Immunsystem steht im Fokus von Doris Wilflingseder und Wilfried Posch, die am Institut für Hygiene und Medizinische Mikrobiologie (Direktorin: Cornelia Lass-Flörl) der Medizinischen Universität Innsbruck forschen.
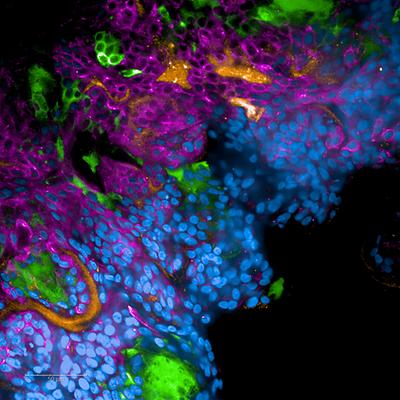
Zytokinsturm in 3D#
Mit den von den beiden WissenschafterInnen entwickelten menschlichen 3D-Modellen für den oberen und unteren Respirationstrakt lassen sich auch Interaktionen des neuen Coronavirus mit dem Immunsystem simulieren und verfolgen. „Unser humanes System erlaubt einen sehr realistischen Nachbau des mehrschichtigen Epithels* von Atemwegen und Lunge. In diesen hoch differenzierten 3D-Gewebesystemen haben wir nun SARS-CoV-2 als Erreger eingesetzt und quasi im Live-Modus beobachtet, wie Epithelzellen des Atmungstraktes die löslichen Komplementfragmente C5a und C3a freisetzen“, so Infektionsbiologin Doris Wilflingseder. Diese sogenannten Anaphylatoxine, die auch in COVID-19 PatientInnen mit kritischem Verlauf erhöht festgestellt wurden, lösen eine starke Entzündungsreaktion aus, sodass in der Folge auch pro-inflammatorische Botenstoffe (Zytokine) am Infektionsherd gebildet werden. Dieser „Zytokinsturm“ ruft schließlich weitere Immunzellen auf den Plan – ein gewebsschädigendes und lebensbedrohliches Infektionsgeschehen (Hyperinflammation), das bereits klinisch beobachtet und hier erstmals und ohne Tierversuche im Labor belegt werden konnte.
Neue Wirkung mit altem Medikament#
Um zu sehen, ob die Hemmung der Anaphylatoxine C3a und C5a eine Hyperinflammation verhindern kann, setzten Wilfried Posch und Doris Wilflingseder chemische Blocker ein. Diese Blocker zeigten eine überzeugende Wirkung und schützten vor Zerstörung des Lungengewebes. „Wir haben basolateral, also auf der nach innen gewandten Seite des Epithels, die chemischen Blocker zugegeben und gesehen, dass v.a. bei Blockade des C5a Rezeptors keine Übertragung und keine Virusreplikation stattfand. Das wäre ein Hinweis darauf, dass das Virus die Hyperinflammation braucht, um sich gut vermehren zu können. In diesem Zusammenhang könnte sich ein anti-C5-Antikörper, der von unserem Institutskollegen Reinhard Würzner mitentwickelt wurde und unter der Bezeichnung Eculizumab bereits zur Therapie komplementvermittelter Krankheiten im Einsatz ist, als hilfreich erweisen“, so der Molekularbiologe Wilfried Posch.
Die Ergebnisse der Innsbrucker ForscherInnen sind somit in mehrfacher Weise innovativ: Neben der Aufdeckung einer neuen therapeutischen Angriffsfläche bedient die durchgeführte Behandlungsstrategie auch das, unter dem Stichwort „Drug-Repurposing“ etablierte Konzept zur Entwicklung neuer Anwendungsmöglichkeiten für bereits zugelassene Arzneimittel. Die für die Medikamentenentwicklung und -zulassung erforderliche lange Zeitspanne könnte damit drastisch verkürzt werden.
Durch den Verzicht auf tierexperimentelle Untersuchungen punktet das von Doris Wilflingseder und Wilfried Posch etablierte humane 3D-System aber vor allem in der präklinischen Phase, also jenem Abschnitt, in dem Unbedenklichkeit und Toxikologie neuer Wirkstoffe getestet werden. „Im Rahmen unseres in Innsbruck etablierten MUI animalFree Research Clusters und in enger Zusammenarbeit mit dem Austrian Drug Screening Institute (ADSI) verfolgen wir das Ziel, valide Alternativen zu Tierversuchen voranzutreiben und so die Testung von potentiellen antimikrobiellen Wirkstoffen mittels modernster Technologien zu erleichtern“, betont Wilflingseder, die als Initiatorin und Sprecherin der transnationalen Plattform agiert und auch in der nationalen und internationalen tierversuchsfreien Forschung bestens vernetzt ist.
Steckbriefe:#
Die Innsbruckerin Doris Wilflingseder studierte Zoologie, Immunologie und Zellbiologie. Die Universitätsprofessorin für Infektionsbiologie ist am Zusammenspiel von Pathogenen mit dem Wirt interessiert. Sie engagiert sich seit Beginn ihrer wissenschaftlichen Tätigkeit für eine tierversuchsfreie Forschung.
Wilfried Posch ist gebürtiger Kufsteiner und studierte Molekularbiologie und Immunologie. Im Fokus seines wissenschaftlichen Interesses stehen die Erforschung neuartiger Infektionskrankheiten und deren Wechselwirkungen mit dem Immunsystem.
*) Epithelien sind die Deckschichten auf allen äußeren und inneren Oberflächen mehrzelliger Organismen. Sie haben einerseits mechanische Schutz- und Abdichtungsaufgaben und kontrollieren andererseits den Stoffaustausch zwischen den Binnengeweben mit ihren weiten Interzellularräumen und der Gewebsaußenwelt. Epithelzellen sind typischerweise polar gebaut: Sie besitzen eine morphologisch und physiologisch unterscheidbare Außen (apikal)- und eine dem Binnengewebe zugewandte Basalseite.
Forschungsarbeit:#