Kathode
Eine Kathode [kaˈtoːdə] (auch Katode, von altgriechisch κάθοδος káthodos „Rückweg“, wörtlich „Weg nach unten“)[1] ist eine Elektrode, an der Elektronen einem System zugeführt werden. Ein System kann ein Vakuum (s. Elektronenröhre), eine Gasphase (s. Gasentladungsröhre), ein Plasma oder ein Elektrolyt sein. Entsprechend der Definition können an dieser Elektrode Reduktionsreaktionen ablaufen, z. B. positive Ionen (Kationen) entladen werden.
Die Kathode ist die Gegenelektrode zur Anode. Zwischen diesen Elektroden wandern Ionen oder freie Elektronen. Die Kationen wandern zur Kathode und die Anionen zur Anode.
Entsprechend der vorliegenden elektrischen Polarität zwischen den Elektroden wird einer Kathode entweder ein Pluspol (+) oder ein Minuspol (−) zugeordnet. Bei freiwillig ablaufenden Redoxreaktionen, wie beim Entladevorgang von Batterien, ist die Kathode die positive Elektrode. Bei einer durch angelegte Spannung erzwungenen Redoxreaktion, wie der Elektrolyse, ist die Kathode die negativ polarisierte Elektrode.
Bei wiederaufladbaren Batterien (Akkumulatoren) arbeitet dieselbe Elektrode entweder als Anode oder Kathode, je nachdem, ob der Akkumulator geladen oder entladen wird.
Chemie
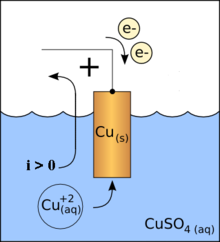
In der Chemie ist eine Kathode die Elektrode, an der eine Reduktionsreaktion stattfindet. Dabei werden Elektronen über den elektrischen Leiter zugeführt und an die chemischen Reaktionspartner über die Elektrode abgegeben. Die elektrochemische Reaktion findet immer an der Phasengrenze zwischen der Elektrode und der Elektrolytlösung (bzw. einem ionenleitenden Feststoff oder einer elektrolytischen Schmelze) statt.
Beispiele für Kathodenreaktionen:
Abscheidung von elementarem Kupfer als Teilreaktion in einem Daniell-Element:
- Cu 2+ + 2 e − → Cu 0 (s)
Freisetzung von gasförmigem Wasserstoff als Teilreaktion der Wasserelektrolyse:
- 2 H 3O + + 2 e − → H 2 (g) + 2 H 2O
Elektrotechnik

In der Elektrotechnik ist die Kathode eine Elektrode einer Elektronenstrahlröhre, Leuchtstofflampe (mit dem Spezialfall Kaltkathodenlampe), Diode, Brennstoffzelle, Bleiakkumulator und so weiter.
Dabei ist die Kathode die Elektrode, an der Elektronen in das umgebende Medium (Elektrolyt, Vakuum, Silizium) übergehen. Elektronen bewegen sich im betrachteten Bauelement von der Kathode zur Anode, um dann durch den außen liegenden elektrischen Stromkreis von der Anode zur Kathode zu fließen. Da sich die Bezugsrichtung für den Stromfluss auf positive Ladungsträger bezieht und damit der Bewegungsrichtung von Elektronen entgegengerichtet ist, fließt also der Strom im äußeren Stromkreis von der Kathode zur Anode. Innerhalb des betrachteten Bauteils fließt der Strom von der Anode zur Kathode; der Stromkreis ist geschlossen.
Diese Aussage hat nichts damit zu tun, ob das Potential der Anode höher oder niedriger als das Potential der Kathode ist; oder in anderen Worten, ob die Spannung von Anode zu Kathode positiv oder negativ ist. Dafür gibt es die Begriffe Pluspol und Minuspol. Dabei ist das Potential des Pluspols immer höher als das Potential des Minuspols. Daher ist die Spannung vom Pluspol zum Minuspol immer größer als null. Damit geben Pluspol und Minuspol die Spannungsrichtung an, während Anode und Kathode mit der Stromrichtung einhergehen.
Bei Bauteilen, bei denen die Anode positive Spannung gegenüber der Kathode aufweist, wird elektrische Energie in eine andere Energieform (Wärme, chemische Energie,...) gewandelt, z. B. bei einer Diode, einer Kathodenstrahlröhre oder einem Akkumulator, der geladen wird.
Bei Bauteilen, bei denen die Anode negative Spannung gegenüber der Kathode aufweist, wird elektrische Energie auf Kosten einer anderen Energieform (z. B. chemischer Energie) an den äußeren elektrischen Stromkreis abgegeben, z. B. bei einer Brennstoffzelle oder einem Akkumulator, der entladen wird.
- Wenn eine angelegte Spannung die materialspezifische Austrittsarbeit der negativen Elektrode überschreitet, treten aus dem Material Elektronen aus (Feldemission); das Material wird an dieser Stelle zur Kathode.
- Die materialbestimmte Austrittsarbeit wird leichter aufgebracht, wenn man zusätzliche Energie zuführt - beispielsweise durch steigende Temperatur. Eine wichtige Anwendung dieses Effektes ist die Glühkathode (Glühemission) bei einer Verstärkerröhre.
- Wenn man zusätzliche Energie durch Bestrahlung mit Licht zuführt, spricht man von einer Photokathode (vergl. Photoeffekt).
Weitere Anwendungen
Sehr aufwändige Kathoden findet man bei Anlagen zur Hochspannungs-Gleichstrom-Übertragung, zum Beispiel in Form von im Meer verlegten riesigen Kupferringen; ebenso in Galvanisierbetrieben oder auch in Akkumulatoren (z. B. Autobatterien) sowie im kathodischen Korrosionsschutz.
Literatur
- International Electrotechnical vocabulary. IEV. Herausgegeben von der Internationale Elektrotechnische Kommission (IEC).
Einzelnachweise
- ↑ Wilhelm Gemoll: Griechisch-Deutsches Schul- und Handwörterbuch. 9. Auflage. Freytag, München u. a. 1965.
Weblinks
- Das IEV im Internet internationales Elektrotechnisches Wörterbuch der International Electrotechnical Commission (IEC)