Muskeldystrophie Duchenne
| Klassifikation nach ICD-10 | ||
|---|---|---|
| G71.0 | Muskeldystrophie | |
| ICD-10 online (WHO-Version 2016) | ||
Die Muskeldystrophie des Typs Duchenne ist die häufigste muskuläre Erbkrankheit im Kindesalter. Sie tritt etwa in einer Frequenz von 1:5000 auf. Aufgrund des X-chromosomal rezessiven Erbganges sind fast nur Jungen betroffen. Die Duchenne-Muskeldystrophie beginnt im Kleinkindalter mit einer Schwäche der Becken- und Oberschenkelmuskulatur, schreitet rasch voran und endet, meist im jungen Erwachsenenalter, immer tödlich, sobald die Herz- und Atemmuskulatur abgebaut wird. Man bezeichnet sie daher auch als „maligne (= bösartige) Muskeldystrophie“. Durch optimierte Therapie mit Heimbeatmung hat sich die Prognose in den letzten Jahren verbessert. Die Muskeldystrophie vom Typ Duchenne wurde von Guillaume-Benjamin Duchenne bereits im 19. Jahrhundert in Paris beschrieben.
Ursachen
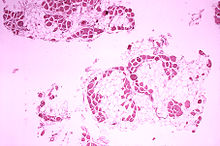
Die Muskeldystrophie Duchenne ist eine genetisch determinierte Synthesestörung des Muskelstrukturproteins Dystrophin. Es wird bei dieser Krankheitsform nicht gebildet. Im Gegensatz dazu wird bei der milder verlaufenden Muskeldystrophie Becker-Kiener Dystrophin in geringerer Menge synthetisiert. Der Dystrophinmangel führt mit der Zeit zum Untergang von Muskelfasern und Ersatz durch Fett- oder Bindegewebe.
Bei der Muskeldystrophie Typ Duchenne ist eine Mutation im Dystrophin-Gen auf dem X-Chromosom (Locus Xp21.2) nachweisbar. Hierbei handelt es sich in 60 bis 70 % um eine Deletion, in ca. 5 % um eine Duplikation und in ca. 35 % um eine Punktmutation. Mehr als 98 % der Mutationen verursachen hierbei eine Verschiebung (Frameshift) des Leserasters und führen damit zu einem kompletten Verlust des Dystrophinproteins. Dabei sind etwa 1/3 der Fälle Neumutationen und nur 2/3 von der nicht manifest erkrankten Mutter (Konduktorin) vererbt.
Symptomatik und Verlauf
Der frühkindliche Entwicklungsverlauf ist zunächst normal. Im 3. bis 5. Lebensjahr fällt bei den betroffenen Kindern eine leichte Muskelschwäche der Beine auf, die zu häufigem Stolpern und Fallen führt. Im weiteren Verlauf ist das Treppensteigen nur mit Zuhilfenahme eines Geländers möglich. Die Muskelschwäche der Becken- und Oberschenkelmuskulatur verursacht einen Watschelgang (Trendelenburgzeichen) sowie ein erschwertes Aufstehen aus dem Sitzen oder Liegen. Die Kinder klettern an sich selbst hoch (Gowers-Manöver) oder nutzen Wände und Möbel zum Abstützen. Ab dem 5. bis 7. Lebensjahr sind das Treppensteigen und Aufstehen aus dem Sitzen oder Liegen nur noch mit Hilfe anderer möglich, da die Erkrankung auch auf die Muskulatur der Schulter und Arme übergreift. Zwischen dem 7. und 12. Lebensjahr ist ein Anheben der Arme in die Waagerechte kaum mehr möglich. Viele Kinder sind in diesem Alter bereits auf den Rollstuhl angewiesen, können sich aber noch eingeschränkt selbständig versorgen. Meist besteht ab dem 18. Lebensjahr vollständige Pflegebedürftigkeit.
Infolge des Muskelschwundes kommt es zu schmerzhaften Fehlstellungen von Gelenken und Knochenverformungen. Charakteristisch für den Typ Duchenne sind die sogenannten „Gnomen-“ oder „Kugelwaden“. Sie entstehen durch Fetteinlagerungen in der bindegewebig umgebauten Unterschenkel-Muskulatur (Pseudohypertrophie). Bei Abbau der Schultergürtelmuskulatur kommt es zu hervorstehenden Schulterblättern („Scapulae alatae“), auch Engelsflügel genannt. Durch Schwäche der Atemmuskulatur wird das Abhusten, bei Infekten der Luftwege, deutlich erschwert und dadurch kann die Lebenserwartung erheblich eingeschränkt werden. Der Herzmuskel ist zwar meist vom Krankheitsprozess betroffen, doch führen erhöhte Herzfrequenz und sonstige Veränderungen des Rhythmus oder auch Beeinträchtigung der Herzkraft selten zu subjektiven Beschwerden. Die Lebenserwartung der Patienten beträgt je nach Verlauf etwa 40 Jahre, jedoch versterben einzelne Patienten auch schon vor Beginn der Pubertät.
In 50 - 95% bildet sich auch eine seitliche Verkrümmung der Wirbelsäule (Skoliose), die etwa dann einsetzt, wenn die Gehfähigkeit verloren geht, meist zwischen 10 - 14 Jahren. Bei etwa 85% der betroffenen Kindern kommt es anfangs zu einer Progression der Skoliose mit mittlerer Zunahme des Cobb-Winkels, der das Ausmaß der Fehlstellung beschreibt, um monatlich 2,1°. Hierdurch wird auch die Lungenfunktion beeinträchtigt und die forcierte Vitalkapazität (FVC) sinkt im Sinne einer restriktiven Lungenfunktionsstörung um etwa 4% pro 10° Zunahme der Skoliose. Es besteht die Möglichkeit, durch eine langstreckige Versteifung der Wirbelsäule (Spondylodese), die Progression und die Verminderung des Lungenvolumens aufzuhalten. Der Eingriff ist aber mit Risiken verbunden und sein Stellenwert ist nicht klar. Eine schottische retrospektive Studie untersuchte die Komplikationsrate bei 26 posterioren Spondylodese-Operationen. Im Mittel waren die Jungen 14,2 Jahre alt, die Operation dauerte mittlere 260 Minuten, der mittlere postoperative Aufenthalt auf der Intensivstation betrug fünf Tage, der Krankenhausaufenthalt im Mittel fünfzehn Tage. Komplikationen zeigten sich deutlich häufiger als bei vergleichbaren Operationen bei anderen Grunderkrankungen und bestanden bei 10 Kindern (39%), davon vier akuten Leberschäden (Hepatotoxizität, mit vollständiger Besserung bei allen Kindern im weiteren Verlauf) und fünf tiefen Wundinfektionen. [1]
Diagnostik
Der Verdacht auf Muskeldystrophie ergibt sich, wenn im Kindesalter eine ungewöhnliche, symmetrisch ausgebildete Schwäche der Muskulatur beobachtet wird. Bei der Anamnese interessieren besonders der Beginn der Funktionsstörungen, der Verlauf und das Auftreten ähnlicher Störungen in der Familie, besonders bei männlichen Verwandten der Mutter. Im Rahmen der körperlichen Untersuchung wird nach allgemeinen Auffälligkeiten geschaut, wie Haltung, Beweglichkeit und Atmung. In der neurologischen Untersuchung wird die Funktion der Nerven und Muskeln überprüft. Laborwerte geben wichtige Hinweise - die Menge an Creatin-Kinase, einem Muskelenzym, ist oft im Blut erhöht. Zu den üblichen Zusatzuntersuchungen gehört die Elektroneurographie, bei der die Nervenleitgeschwindigkeit bestimmt wird, und die Elektromyographie, die unterscheiden hilft, ob eine primäre Muskelerkrankung oder eine Erkrankung der motorischen Nerven die Ursache der Schwäche ist. Als bildgebende Verfahren werden MRT und Ultraschall eingesetzt. Hier können ohne Belastung des Patienten strukturelle Veränderungen der Muskeln beurteilt werden. Die Muskelbiopsie erlaubt die Untersuchung des Muskels unter dem Licht- oder Elektronenmikroskop. Die Stoffwechselvorgänge im Muskel können damit genau untersucht werden. Die Gendiagnostik bestätigt die Diagnose und macht eine genaue Zuordnung nach Typus möglich.
Therapie
Eine Heilung ist nicht möglich. Der Versuch, die Duchenne-Muskeldystrophie gentherapeutisch zu behandeln, schlug vorerst fehl. Grund dafür war vermutlich eine Autoimmunreaktion nach dem Versuch, die entsprechenden Gene in ein Muskelprotein einzubringen. Weitere Studien mit adjuvanter Immunmodulation wurden im Oktober 2010 durchgeführt.[2]
Eine effektive Behandlung bedarf einer Zusammenarbeit von Arzt, Physiotherapie, Ergotherapie und Pflege, oft auch psychologischer Unterstützung für die Betroffenen und ihre Angehörigen. Ziel aller physiotherapeutischen Maßnahmen ist es, die Folgen der Muskelschwäche so gering wie möglich zu halten bzw. in einem bestimmten Ausmaß zu korrigieren. Durch ökonomisches Training mit leichter bis mäßiger Belastung wie Gehen, Schwimmen und Fahren auf dem Ergometer ist eine Verbesserung der Ausdauer und damit eine Minderung der Schwäche zu erreichen. Kortisongaben und operative Lösung von Kontrakturen verlängern die Gehfähigkeit, Kreatin kann eine diskrete Verbesserung des Muskelenergiestoffwechsels bewirken (regelmäßige Therapiepausen nötig). Eine sich entwickelnde Skoliose (Verkrümmung der Wirbelsäule) kann durch die Implantation von Metallstäben (Harrington-Stab) operativ begradigt werden; hierdurch wird vor allem die Atemfunktion verbessert. Seit 1989 werden mitwachsende Teleskopstäbe eingesetzt. Als Hilfsmittel werden Orthesen, Rollstuhl, Duschstuhl, Badewannenlifter, Toilettensitzerhöhungen und Rollstuhlrampen eingesetzt. Da durch die zunehmende Schwäche der Atemmuskulatur die Eigenatmung immer weiter abnimmt, kann zwischen dem durchschnittlichen Alter von 18 und 20 Jahren eine maschinelle Beatmung notwendig werden.[3] Dies erfolgt überwiegend nicht-invasiv, über eine Nasen- oder Nasen-Mund-Maske. Die Durchführung einer Tracheotomie ist anfangs meist nicht notwendig und wird normalerweise erst spät, wenn der Patient auch tagsüber auf die Beatmung angewiesen ist, durchgeführt. Von einer generellen Tracheotomierung ist man inzwischen weitgehend abgerückt. Besonders zu beachten ist auch die Abhustschwäche. Durch physiotherapeutische Techniken oder apparative Maßnahmen ist auch dabei eine Unterstützung möglich. Eine mit der Muskeldystrophie einhergehende Fatigue kann – neben hinreichenden Ruhephasen – mit Vitamininfusionen und Sauerstoffbehandlungen positiv beeinflusst werden. Ein weiterer Ansatz beruht darauf, das defekte Gen trotz der Mutation vollständig auszulesen. Dies soll z. B. mit Hilfe von Ataluren möglich sein. Sobald die Krankheit auf die Atemmuskulatur übergreift, müssen regelmäßige Lungenfunktionstests erfolgen. In den letzten Jahren wurden gute Fortschritte in der Möglichkeit der Heimbeatmung gemacht. Bei der Erstellung eines Trainingsprogramms muss die Herzbelastbarkeit überprüft werden. Manchmal kann der Einsatz eines Herzschrittmachers notwendig sein.
In einer kanadischen nicht randomisierten klinischen Vergleichsstudie mit 54 Jungen, die bei Studienbeginn im Mittel 8,7 Jahre alt waren und von denen 30 täglich 0,9 mg/kg KG Deflazacort und 24 keine Therapie erhielten, waren im Mittel nach 15,2 Jahren ein Junge mit Therapie (3 %) und fünf Jungen ohne Therapie (21 %) verstorben. Signifikant mehr Jungen ohne Therapie hatten eine schwere Skoliose entwickelt und waren daran operiert worden (sechs (20 %) bzw. zweiundzwanzig (92 %) Jungen mit bzw. ohne Cortisontherapie). Unter Therapie war die Lungenfunktion signifikant besser, die Kinder liefen länger selbständig und konnten im Mittel anderthalb Jahre länger ohne Assistenz eine Treppe hochgehen. Allerdings entwickelten einundzwanzig Jungen (70 %) unter Cortison einen Katarakt (und kein Kind ohne Therapie), es wurden aber nur zwei Kinder am Katarakt operiert. Die Größe war unter Cortison im Mittel 17 cm geringer, das Gewicht mittlere 4 kg höher.[4]
Eine behutsame genetische Beratung der Eltern gehört zur Therapie. Ist die Mutter Konduktorin, so haben Brüder betroffener Kinder eine 50 %ige Wahrscheinlichkeit, ebenfalls zu erkranken, Schwestern sind mit gleicher 50 %iger Wahrscheinlichkeit asymptomatische Trägerinnen (Konduktorinnen) des defekten Gens.
Einzelnachweise
- ↑ A. D. Duckworth, M. J. Mitchell, A. I. Tsirikos: Incidence and risk factors for post-operative complications after scolioses surgery in patients with Duchenne muscular dystrophy. The Bone & Joint Journal 2014, Band 96-B, Ausgabe 6 vom Juli 2014, Seiten 943-949; doi:10.1302/0301-620X.96B7.33423
- ↑ New England Journal of Medicine, Band 363, 2010, S. 1429–1437
- ↑ Anita K. Simonds: Recent advances in respiratory care for neuromuscular disease. In: Chest, Band 130, Dezember 2006, S. 1881, Abschnitt DMD.
- ↑ David E. Lebel, John A. Corston, Laura C. McAdam, W. Douglas Biggar, Benjamin A. Alman: Glucocorticoid treatment for the prevention of scoliosis in children with Duchenne Muscular Dystrophy: Long-term follow-up. In: Journal of Bone and Joint Surgery, Band 95, Nr. 12, 19. Juni 2013, S. 1057–1061, doi:10.2106/JBJS.L.01577.
|
|
Dieser Artikel behandelt ein Gesundheitsthema. Er dient nicht der Selbstdiagnose und ersetzt keine Arztdiagnose. Bitte hierzu diesen Hinweis zu Gesundheitsthemen beachten! |