Multiples Myelom
| Klassifikation nach ICD-10 | ||
|---|---|---|
| C90.0 | Plasmozytom (multiples Myelom) | |
| ICD-10 online (WHO-Version 2016) | ||
Das Multiple Myelom (häufig synonym verwendet: Plasmozytom, Kahler-Krankheit nach Otto Kahler, Huppert-Krankheit) ist eine Krebserkrankung des Knochenmarks. Sie ist gekennzeichnet durch bösartige Vermehrung Antikörper-produzierender Zellen, der Plasmazellen. Die entarteten Plasmazellen produzieren in der Regel Antikörper oder Bruchstücke davon. Da alle malignen Plasmazellen von einer gemeinsamen Vorläuferzelle abstammen, sind sie genetisch identisch (Zellklon) und produzieren identische (= monoklonale) Antikörper.
Das Ausmaß der Bösartigkeit (der Grad der Malignität) kann sehr unterschiedlich sein und reicht von Krebsvorstufen über nur langsam voranschreitende Krankheitsverläufe bis zu hochmalignen, ohne Behandlung schnell zum Tod führenden Erkrankungen.
Krankheitssymptome entstehen entweder durch das bösartige Wachstum der Plasmazellen oder durch die Eigenschaften der gebildeten Antikörper oder Antikörperbruchstücke. Das Wachstum der Plasmazellen führt zu Knochenschmerzen und Auflösung der Knochen bis zu spontanen Knochenbrüchen, Anstieg des aus dem Knochen gelösten Calciums im Blut und Abnahme der im Knochenmark gebildeten roten Blutkörperchen. Die im Übermaß produzierten und oftmals abnormalen Antikörper können durch Ablagerung im Gewebe zu Funktionsstörungen vieler Organe, zu Nierenversagen und zur Beeinträchtigung der Durchblutung führen.
Die Diagnose wird durch Blutuntersuchung, Röntgen der großen Knochen und Knochenmarkpunktion gestellt.
Im Frühstadium der Erkrankung wird der Krankheitsverlauf nur beobachtet. Treten Symptome und Komplikationen auf, können Betroffene mit Chemotherapie, Medikamenten, die das Immunsystem beeinflussen, Medikamenten, die die Knochenauflösung hemmen, und Knochenmarktransplantation behandelt werden.
Die Überlebensraten haben sich innerhalb der letzten 10 Jahre durch neue Medikamente, wie Bortezomib, Lenalidomid, Pomalidomid und Thalidomid signifikant verbessert.[1][2][3]

Terminologie
Das Plasmozytom zählt per Definition zu den indolenten B-Zell-Non-Hodgkin-Lymphomen.[4] Strenggenommen ist Multiples Myelom die korrekte Bezeichnung der Erkrankung, während der Begriff Plasmozytom nur das isolierte Multiple Myelom bezeichnet, bei dem die Erkrankung auf einen einzigen lokalen Krankheitsherd (in der Regel eine Osteolyse = lokale Knochenauflösung) begrenzt ist. Im allgemeinen klinischen Sprachgebrauch hat sich aber eingebürgert, dass beide Begriffe weitgehend synonym gebraucht werden, d. h. wenn von Plasmozytom gesprochen wird, ist meistens ein Multiples Myelom gemeint. Auch in diesem Artikel werden die Begriffe, wenn nicht explizit anders gesagt, in diesem Sinne verwendet. Abzugrenzen vom Multiplen Myelom/Plasmozytom ist die „Monoklonale Gammopathie unklarer Signifikanz“ (MGUS), bei der ebenfalls eine klonale Immunglobulinproduktion vorliegt.
Epidemiologie
Die Inzidenz des Multiplen Myeloms liegt bei etwa 4–6 Neuerkrankungen/100.000 pro Jahr. 10 % aller hämatologischen Krebserkrankungen bzw. 1 % aller Krebserkrankungen sind Multiple Myelome.[5] Es ist eine Erkrankung des höheren Lebensalters, das mediane Alter bei Diagnosestellung liegt bei 66 Jahren, nur 2 % der Patienten sind jünger als 40 Jahre. Bei Kindern tritt es sehr selten auf.[6] Es tritt bei Männern etwas häufiger als bei Frauen auf, bei Afroamerikanern kommt die Erkrankung im Vergleich zur weißen US-amerikanischen Bevölkerung etwa doppelt so häufig vor.
Risikofaktoren für die Entstehung eines multiplen Myeloms
Die pathogenetische Ursache des Plasmozytoms ist weitgehend unbekannt. Diskutiert wird der Einfluss ionisierender Strahlung, zum Teil wurden verschiedene genetische Translokationen beschrieben, deren Einfluss aber noch nicht geklärt ist.
Pathogenese
Der Übergang von einer monoklonalen Gammopathie unklarer Signifikanz zum aktiven Myelom verläuft in vielen aufeinanderfolgenden Schritten und kann wenige Monate bis mehrere Jahrzehnte dauern.[7]
Die maligne Entartung der Plasmozytom-Zellen findet meist außerhalb des Knochenmarks in Keimzentren peripherer lymphatischer Organe statt. Die B-Zellen, die in diese Keimzentren eintreten, haben schon die ersten Differenzierungschritte (V-D-J-Rearrangements und Isotyp-switch) hinter sich. In diesem Stadium treten die genetischen Veränderungen ein, die letztlich zur Entstehung des Plasmozytoms führen.
Bei den meisten Patienten beobachtet man Translokationen, die bewirken, dass ein Onkogen unter die Kontrolle eines regulatorischen Gens gelangt und somit stark aktiviert wird. Beim Plasmozytom ist dies am häufigsten (ca. 80 %) das Immunglobulin-Enhancer-Gen auf Chromosom 14 Genlocus q31. Häufige Partner dieser Translokation sind Teile des Chromosoms 4 (4p16.3; Fibroblast Growth Factor Receptor), 6 (6p21; Cyclin D3), 11 (Bcl-1, Cycin D1), 20 (20p11; maf8) und 16 (16q23; C-maf). Selten findet man 8q24 (c-myc) und noch seltener 18q21 (bcl-2), 11q23 (MLL-1) sowie 20q11 (maf B). Im weiteren Verlauf der Erkrankung treten noch andere genetische Veränderungen hinzu. Die unterschiedlichen genetischen Veränderungen gehen mit unterschiedlichen Krankheitsverläufen einher und definieren möglicherweise eigene Krankheiten.
Der Nachweis bestimmter genetischer Veränderungen in Plasmozytomzellen eines Patienten lässt in manchen Fällen Rückschlüsse auf die Prognose zu. So weiß man beispielsweise, dass eine Deletion von Chromosom 13 (Monosomie 13) ein Hinweis auf eine kürzere Überlebenszeit sein kann.
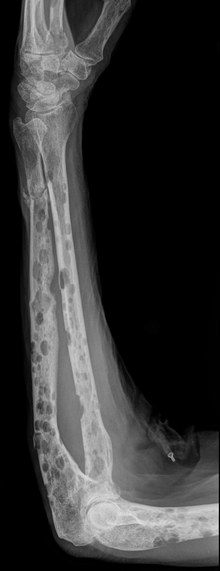
Nach der klonalen Vermehrung einer entarteten Plasmazelle kommt es zur Infiltration des Knochenmarks mit folgender Zerstörung des Knochens und Verdrängung der normalen Hämatopoese (Blutbildung). Hierbei scheiden die malignen Zellen Wachstumsfaktoren und Zytokine aus, welche die Osteoklasten aktivieren (u. a. OAF), was letztlich zu einem Knochenabbau führt. Dies führt zu einer allgemeinen Osteoporose sowie zu den charakteristischen, im Röntgenbild sichtbaren Knochenschäden, die im Gegensatz zu Knochenmetastasen wie ausgestanzt dargestellt werden. Es fehlt der bei Knochenmetastasen sonst vorhandene Saum aus reaktiven Zellen („osteoblastischer Randsaum“). Dies ist auch der Grund dafür, dass sich die Knochenveränderungen bei einem Plasmozytom nicht im Knochenszintigramm darstellen können. Insgesamt entwickeln etwa 60 % der Patienten Knochenveränderungen.
Die malignen Zellen bilden Antikörper oder Antikörperteile (sogenannte Leichtketten), welche sich im Körper anreichern und für viele Symptome und Komplikationen der Erkrankung verantwortlich sind.
Entsprechend dem gebildeten Antikörper werden folgende Typen unterschieden:
Symptome
Bei einigen Patienten wird die Erkrankung zufällig im Rahmen einer Blutuntersuchung anhand einer auffälligen Serumelektrophorese diagnostiziert.
Bei den meisten Patienten treten jedoch Symptome und Komplikationen auf:
- Allgemeinsymptome wie Schwäche und Gewichtsverlust;
- Verminderung der Knochenmarksfunktion (Knochenmarkinsuffizienz) mit Blutarmut (Anämie), Verminderung der weißen Blutkörperchen (Leukopenie) und/oder der Blutplättchen (Thrombozytopenie);
- oft fällt ein sehr starker Abbau der Knochensubstanz (Osteoporose) als erstes Symptom auf, „Osteoporose“ wird als häufige Fehldiagnose gestellt;
- Infektanfälligkeit durch Antikörpermangel (die vom Plasmozytom gebildeten Antikörper sind ohne Funktion) und Mangel an weißen Blutkörperchen (Leukopenie);
- Knochenschmerzen und Knochenbrüche durch Auflösung des Knochengewebes (Osteolysen). Osteolysen im Schädelknochen stellen sich im Röntgenbild als sogenannter „Schrotschussschädel“[8] dar;
- Hyperkalzämie (erhöhter Calciumspiegel im Blut) kann zu Schwäche und Nierenschäden führen;
- die überschießende Bildung von Immunglobulinen kann die Viskosität des Serums erhöhen. Dies kann zu Störungen der Mikrozirkulation führen, die sich in Kopfschmerzen, Benommenheit, Schwindel, Nystagmus, Hör- und Sehstörungen, Schläfrigkeit, Koma und Krampfanfällen äußern (Hyperviskositätssyndrom);
- die Ausscheidung von Leichtketten im Urin kann die Nierenfunktion auf unterschiedliche Weise beeinträchtigen:[9]
- In den Nierenkanälchen kann es in Gegenwart von Uromodulin zu Ausfällungen der Leichtketten in Form von Eiweißzylindern (Cast-Nephropathie) kommen. Diese Ausfällungen wirken direkt toxisch auf die Zellen der Nierenkanälchen und können zu einem raschen Verlust der Nierenfunktion (akutes Nierenversagen) führen (klassische Myelomniere).
- Ablagerung von Leichtketten in den Basalmembranen von Nierenkörperchen und Nierenkanälchen kann zur Leichtketten-Ablagerungs-Krankheit (light-chain deposition disease) führen. Diese äußert sich in einer stark vermehrten Ausscheidung von Eiweiß im Urin (nephrotisches Syndrom) und führt zu einem chronischen Nierenfunktionsverlust.
- Die Leichtketten können zu Funktionsstörungen der Zellen im Hauptstück der Nierenkanälchen führen (Fanconi-Syndrom). Diese Funktionsstörungen äußern sich in einer verminderten Ausscheidung von Säuren (Azidose) sowie einem vermehrten Verlust von Phosphat, Glukose, Harnsäure und Aminosäuren.
- Durch Zusammenlagerung von Leichtketten im Bereich der β-Faltblatt-Strukturen können sich Fibrillen bilden, feine langgestreckte Strukturen, die sich in Form von Amyloid in Nierengewebe und Nierengefäßen ablagern. Folge sind wie bei der Leichtketten-Ablagerungs-Krankheit erhöhte Eiweißausscheidung und chronischer Nierenfunktionsverlust.
Diagnose
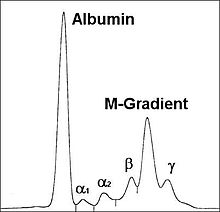

Einen Hinweis auf das Vorliegen eines Plasmozytoms gibt der Nachweis einer monoklonalen Gammopathie im Blut und/oder einer Leichtkettenausscheidung im Urin durch Serumelektrophorese und Immunelektrophorese oder Immunfixationselektrophorese. Man findet monoklonale Immunglobuline aber auch bei MGUS (monoklonale Gammopathie unklarer Signifikanz) sowie ebenfalls bei reaktiven Knochenmarkveränderungen. Einen wichtigen Hinweis auf das Vorliegen eines Plasmozytoms geben aber deutlich erhöhte Serumkonzentrationen (IgG > 3,5 g/dl, IgA > 2,0 g/dl) oder der Nachweis einer erhöhten Konzentration von Leichtketten im Urin (> 1,0 g/24h).
Eine Knochenmarkpunktion zeigt im Fall eines multiplen Myeloms eine Infiltration durch Plasmazellen. Diese können manchmal eine atypische Form aufweisen, häufig gibt aber nur der gesteigerte Anteil an Plasmazellen einen Hinweis auf die Erkrankung. Man findet auch bei Entzündungen oder reaktiven Veränderungen im Knochenmark Plasmazellanteile bis zu 30 %.
Werden zusätzlich zu einem Paraprotein und zur Plasmazell-Vermehrung im Knochenmark noch weitere typische Komplikationen, wie eingeschränkte Nierenfunktion, Hyperkalziämie, Anämie oder typische Knochenveränderungen festgestellt, so gilt die Diagnose des Plasmozytoms normalerweise als gesichert.
Osteolysen lassen sich mit konventioneller Röntgen-Untersuchung der Knochen nachweisen. Das Skelettszintigramm zeigt oft keine Aktivitätsänderung im osteolytischen Bereich, ist hier also nicht verlässlich. Ein Knochenszintigramm eignet sich aber zum Nachweis von Knochenbrüchen (pathologische Fraktur) aufgrund der Infiltration durch das Plasmozytom. Zur Frühdiagnose einer Plasmozytominfiltration in den Knochen kann das MRT beitragen, hier zeigt sich auch die Reaktion im Weichteilmantel, bevor es zu Osteolysen gekommen ist.
Typische weitere Laborveränderungen sind eine sehr stark erhöhte Blutkörperchensenkungsgeschwindigkeit (sogenannte Sturzsenkung >100 mm/h) sowie eine erhöhte LDH, ein erhöhtes CRP und ein erhöhtes β2-Mikroglobulin.
Differenzialdiagnostisch abzugrenzen ist neben reaktiven Knochenmarkveränderungen das smoldering Myeloma und anderen malignen Lymphomen die eher harmlose monoklonale Gammopathie unklarer Signifikanz (MGUS).
Diagnostische Kriterien
Hauptkriterien
- Monoklonale Paraproteinämie:
- Serum: IgG >35 g/l, IgA >20 g/l
- Urin: Bence-Jones-Proteinurie >1 g/24h
- Knochenmarkinfiltration von >10 % Plasmazellen
- histologischer Plasmozytomnachweis in sonstigen Biopsien
Nebenkriterien
- Knochenmarkinfiltration von <10 % Plasmazellen
- monoklonale Paraproteinämie in geringerer Konzentration als im Hauptkriterium
- Osteolysen
- Antikörpermangel: IgM <0,5 g/l, IgA <1 g/l, IgG <6 g/l[10]
Stadieneinteilung
Die Einteilung nach Durie und Salmon unterscheidet 3 Stadien:
| Stadium | Merkmale |
|---|---|
| Stadium I | Hämoglobin > 10 g/dl Kalzium im Serum normal maximal eine Osteolyse IgG < 50 g/l bzw. IgA < 30 g/l Leichtkettenausscheidung im Urin < 4 g/24h |
| Stadium II | zwischen Stadium I und III |
| Stadium III | mindestens eines der folgenden Kriterien: Hämoglobin < 8,5 g/dl Kalzium > 3,0 mmol/l > 2 Osteolysen IgG > 70 g/l IgA > 50 g/l Leichtkettenausscheidung im Urin > 12 g/24h |
| Zusatz A B |
falls Kreatinin < 2 mg/dl (177 µmol/l) falls Kreatinin ≥ 2 mg/dl (177µmol/l) |
Neuer ist die Einteilung nach dem International Staging System (ISS), wo nur β2-Mikroglobulin und Albumin berücksichtigt werden (Greipp, 2005).
| ISS I | β2-Mikroglobulin < 3,5 mg/l und Albumin ≥ 35 g/l |
| ISS II | β2-Mikroglobulin < 3,5 mg/l und Albumin < 35 g/l oder β2-Mikroglobulin 3,5–5,5 mg/l |
| ISS III | β2-Mikroglobulin > 5,5 mg/l |
Therapie
Bis zum heutigen Stand der Wissenschaft ist eine Heilung des multiplen Myelom nicht möglich. Bei Patienten, bei denen das multiple Myelom noch keine Symptome verursacht, wird der Zustand erst einmal nur beobachtet und kontrolliert. Regelmäßige Labortests sowie Röntgen- und Knochenmarkuntersuchungen informieren über den Verlauf. Eine Einleitung der Therapie ist beispielsweise dann erforderlich, wenn sich Knochenveränderungen zeigen. Es gibt inzwischen zahlreiche Behandlungsmöglichkeiten, die den Erkrankungsstand über einen längeren Zeitraum stabil halten, die Beschwerden mindern und die Lebensqualität für die Betroffenen deutlich erhöhen können.
Therapie der Primärerkrankung
Die Primärtherapie wird für jeden Patienten immer individuell festgelegt. Ganz wesentlich beeinflusst z. B. das Alter die Therapieentscheidung. Auch die körperliche Allgemeinverfassung und das Ausmaß der begleitenden Erkrankungen spielen eine große Rolle, zu welcher Therapie man sich entschließt. Theoretisch kommen folgende Möglichkeiten infrage, wobei ein höheres Alter z. B. eine Stammzelltransplantation ausschließt:[1][2][3]
Chemotherapie
Die klassische Kombinationstherapie besteht aus dem Zytostatikum Melphalan und dem Kortison-Präparat Prednison. Die Chemotherapie läuft üblicherweise in Zyklen ab. Bekannte und gefürchtete Nebenwirkungen sind Haarverlust und Übelkeit. (Diese Nebenwirkungen können heute jedoch durch wirksame Medikamente gemildert oder ganz vermieden werden.) Ein weiteres Chemotherapeutikum ist Bendamustin, das sich durch ein günstigeres Nebenwirkungsprofil auszeichnet.
Autologe Stammzelltransplantation
Hierbei handelt es sich um die Transplantation von eigenen Stammzellen. Dabei werden Stammzellen aus dem Knochenmark des Patienten gewonnen und nach erfolgter Chemotherapie dem Patienten wieder zurückgegeben. Diese Stammzellen führen meist innerhalb von kurzer Zeit zur Regeneration der Blutbildung.
Allogene Stammzelltransplantation
Dabei – wesentlich seltener – werden Stammzellen eines fremden Spenders transplantiert. Für dieses Verfahren müssen die Patienten bestimmte Voraussetzungen mitbringen. Das blutbildende System des Empfängers wird nachhaltig zerstört, um durch die Gabe von möglichst identischen Blutstammzellen ein neues hämatopoetisches System zu schaffen, welches frei von kranken Blutzellen ist. Im Gegensatz zur autologen Übertragung besteht zwar grundsätzlich die Gefahr der Transplantat-gegen-Wirt-Reaktion (Graft-versus-Host disease), allerdings kann dieses Phänomen auch den positiven Effekt der Graft-versus-Malignom-Reaktion (Graft-versus-Malignom-Effekt) mit sich bringen. Die Patienten müssen bis zu einem Jahr Medikamente zur Unterdrückung der Abstoßungsgefahr (Immunsuppressiva) einnehmen. Die allogene SZT ist die einzige Organtransplantation, bei der die Immunsuppressiva nicht lebenslang eingenommen werden müssen.
Strahlentherapie
Im Gegensatz zu einer Chemotherapie wirkt eine Strahlentherapie lokal. Mit ihrer Hilfe soll die Teilungsfähigkeit der bösartigen Zellen gestoppt werden. Das weitere Wachstum des Tumors soll verhindert werden. Als Nebenwirkungen können Hautrötungen, Durchfall und Erbrechen auftreten.
Immunmodulation
Immunmodulierende Substanzen (IMiDs für den englischen Begriff: Immunomodulatory Drugs) haben sich in den vergangenen Jahren als ausgesprochen wirksames Mittel gegen Krebserkrankungen erwiesen. Dabei wird die Ausschüttung von entzündungs- oder tumorfördernden Stoffen gehemmt. Zu den IMiDs gehören: Revlimid (Lenalidomid) und Thalidomid; Pomalidomid ist in den USA unter dem Handelsnamen Pomalyst auf dem Markt. In Europa wurde Pomalidomid im August 2013 mit dem Handelsnamen Imnovid zugelassen.[11][12]
Anders als beispielsweise eine Chemotherapie, bei der neben der Zerstörung des Tumorgewebes die vorübergehende Beeinträchtigung der gesunden Zellen unvermeidlich ist, wirken IMiDs gezielt gegen die tumorauslösenden Prozesse. Für die Behandlung von Patienten, die mindestens eine vorausgegangene Therapie erhalten haben, wurde von der Europäischen Arzneimittelagentur (EMA) im Juli 2007 die perorale Lenalidomid Darreichungsform (Revlimid Hartkapseln, Celgene) in Kombination mit Dexamethason zugelassen. Es wurde als sogenanntes Arzneimittel für seltene Leiden (Orphan-Arzneimittel) eingestuft. In Verbindung mit Dexamethason ist es bei Rückfällen oder Therapieversagen effektiver als eine Monotherapie mit Dexamethason.[13] Lenalidomid verfügt neben der immunmodulierenden Wirkung über weitere Mechanismen der Tumorbekämpfung:
- Aktivierung von Immunzellen (T-Zellen und natürliche Killerzellen, die ihrerseits die Tumorzellen angreifen)
- Wachstumsstopp durch direkten Angriff auf die Tumorzellen
- Angiogenesehemmung (Hemmung der Neubildung von Blutgefäßen, welche den Tumor mit Nährstoffen versorgen)
- Unterdrückung der Freisetzung von tumorfördernden Botenstoffen
Thalidomid steht bereits seit 2001 für die Behandlung des multiplen Myeloms zur Verfügung.
Proteasominhibition
Proteasomen sind Eiweißkomplexe, die das Wachstum und das Absterben der Zellen (Apoptose) regulieren. Proteasominhibitoren sind Substanzen, die die Aktivität von Proteasomen hemmen (inhibieren). Sie bewirken eine Verlangsamung des Zellwachstums und eine Beschleunigung der Apoptose.
Der erste sowohl in den USA als auch in der EU zugelassene Proteasominhibitor ist Velcade (Bortezomib); Carfilzomib (Kyprolis) ist bisher nur in den USA zugelassen und befindet sich noch im Zulassungsverfahren innerhalb der EU.
Supportivtherapie
Oft werden zusätzlich verschiedene Organe in Mitleidenschaft gezogen, z. B. in Form von Knochenschädigung und Schmerzen, Kompression des Rückenmarks, eingeschränkte Nierenfunktion, Hyperkalzämie, Bluthochdruck, Infektionen und / oder Anämie. Ergänzende (sogenannte supportive) therapeutische Maßnahmen können helfen, die Symptome einzudämmen und Komplikationen vorzubeugen.
Prognose
Eine medizinisch begründete Vorhersage zur Entwicklung des Krankheitsverlaufs ist schwer zu treffen. Denn viele verschiedene Faktoren spielen eine Rolle, z. B. das Alter bei Krankheitsbeginn, die körperliche Allgemeinverfassung, das Ausmaß der begleitenden Erkrankungen, das Auftreten von Komplikationen oder unvorhergesehenen Ereignissen und/oder das Ansprechen auf die Behandlungsmaßnahmen. Die Überlebensraten haben sich innerhalb der letzten 10 Jahre durch die neuen Therapiemöglichkeiten (s.o.) signifikant verbessert. Sie können das Leben und die beschwerdefreie Zeit verlängern. Nicht zuletzt erhöhen sie die Lebensqualität von Betroffenen und Angehörigen.[1]
Geschichte des multiplen Myeloms
Das multiple Myelom ist keine Erscheinung der Neuzeit, bereits seit vielen Jahrhunderten werden Menschen von dieser Erkrankung heimgesucht. So weisen schon Knochenfunde aus dem 2. Jahrhundert v. Chr. die typischen zerstörerischen Merkmale der Erkrankung auf.[14]
Historischer Fallbericht: Thomas McBean (1850)
Der erste gut dokumentierte Fall eines multiplen Myeloms geht auf Macintyre zurück.[15][16] Er beschrieb die Krankheitsgeschichte des englischen Gemischtwarenhändlers Thomas A. McBean, welcher sich 1845 im Alter von 45 Jahren in seiner Arztpraxis vorgestellt hatte. McBean beklagte, dass etwas mit seinem Urin nicht stimmte – er verspürte häufig Harndrang, und sein „Leibkleid wurde durch den Urin ganz steif“, obwohl er keinen Ausfluss aus der Harnröhre bemerkt hatte. Außerdem litt der Patient an ungewöhnlicher Schwäche und Ausgezehrtheit, während eines Spaziergangs habe er dann das Gefühl gehabt, „etwas im Brustkorb knackte oder gab nach“, und McBean stürzte und konnte sich „wegen starker Schmerzen für einige Minuten nicht mehr erheben“. Doktor Macintyre behandelte den Patienten mit einer Bandage des Brustkorbes („strengthening plasters“) und verordnete körperliche Schonung.[15] Einen Monat später hatte der Patient erneut starke Schmerzen, woraufhin man wiederholte Aderlässe, Blutegelbehandlungen und Schröpfkegel einsetzte, was jedoch keine dauerhafte Linderung brachte, so dass sich McBean bei einem anderen Arzt, Dr. Watson, vorstellte. Dieser begann eine Behandlung mit Eisen und Chinin, was zu einer erstaunlichen Besserung führte, die ein halbes Jahr anhielt. Im Oktober 1845 erlitt der Patient jedoch starke Schmerzen an der Wirbelsäule und dem Ischias, welche sich auch durch den Einsatz von warmen Bädern, Campherpuder und -salbe nicht besserten. Dr. Macintyre diagnostizierte außerdem Ödeme am Körper von McBean und untersuchte daher den Urin des Patienten. Dieser war dunkel und flockte bei Erhitzung aus („abound in animal matter“). Fast gleichzeitig schickte Watson mit der Frage „What is it?“ eine Urinprobe an den Arzt und Chemiker Bence Jones, welcher Proteine im Urin von McBean – und anderer Patienten mit ähnlichen Beschwerden – feststellte und diese charakterisierte.[17] Der Zustand von McBean verschlechterte sich im Verlaufe des Jahres 1845 rapide, er hatte starke Schmerzen und konnte das Bett nicht mehr verlassen. Am 1. Januar 1846 verstarb McBean schließlich, in seiner Todesurkunde wurde „Atrophie durch Albuminurie“ als Todesursache festgehalten.[16]
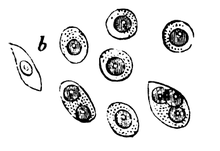
Die Obduktion, bei der die Doktoren Macintyre, Watson und Jones anwesend waren, zeigte Knochen, die „leicht mit dem Messer zu schneiden waren und einfach brachen“. Die Rippen zerbröckelten förmlich und enthielten eine blutrote, gelatineartige und ölige Masse. Auch die gesamte Wirbelsäule war von ähnlicher Beschaffenheit. Becken-, Oberarm- und Oberschenkelknochen „widerstanden jedoch jedem Versuch, sie mit der Hand zu brechen“. Herz, Lunge und Leber wurden als weitgehend unauffällig beschrieben.[15] John Dalrymple, Chirurg und Mitglied der mikroskopischen Fachgesellschaft, untersuchte zwei Lendenwirbel und eine Rippe von McBean. Er stellte Löcher im Knochen des Patienten fest, welche mit einer roten, gelartigen Masse gefüllt waren. Diese untersuchte er unter dem Mikroskop und fand große, gleichförmig aussehende runde bis ovale Zellen, teilweise mit mehreren Nuclei. Die nach Zeichnungen von Dalrymple angefertigten Holzschnitte zeigen die noch heute gültigen Kriterien für Myelomzellen.[16]
Literatur
- RA Kyle, SV Rajkumar: Multiple myeloma. In: N Engl J Med, 2004, 351, S. 1860–1873, PMID 15509819.
- PG Richardson, C Mitsiades, T Hideshima, KC. Anderson: Proteasome Inhibition in the Treatment of Cancer. In: Cell Cycle, 2005, 4(2), PMID 15655370.
- B Barlogie, J Shaughnessy, G Tricot et al.: Treatment of multiple myeloma. In: Blood, 2004, 103, S. 20–32, PMID 12969978.
- H Ludwig, HJ Schmoll: Multiples Myelom. In: Schmoll, Höffken, Possinger: Kompendium Internistische Onkologie. Therapiekonzepte maligner Tumoren. 4. Auflage, Springer Verlag, Heidelberg 2006, ISBN 3-540-20657-4, S. 3165–3206.
Weblinks
- Myelom Deutschland e. V.
- AMM-Online, Netzwerk für Myelom-Patienten, Informationsportal mit Patientenforum
- Informationen der Deutschen Krebshilfe (PDF; 1,25 MB)
- Myelom Kontaktgruppe Schweiz
- Multiples Myelom Hilfe Österreich
- Multiples Myelom Pathologie – Bilddatenbank Pathopic der Universität Basel; PathoPic – Anleitung (PDF; 2,2 MB)
- International Myeloma Foundation englischsprachige Seite der „International Myeloma Foundation“ (deutschsprachiges verständliches Patientenhandbuch).
- The Myeloma Beacon Englischsprachige Seite mit aktuellen Informationen zum Multiplen Myelom.
- Operative Therapienotwendigkeit beim Multiplen Myelom
Einzelnachweise
- 1 2 3 S K Kumar u. a.: Improved survival in multiple myeloma and the impact of novel therapies. In: Blood. 2008 Mar;111(5), S. 2516–2520, doi:10.1182/blood-2007-10-116129.
- 1 2 M Gentile u. a.: Emerging biological insights and novel treatment strategies in multiple myeloma. In: Expert Opinion on Emerging Drugs. 2012 Sept;17(3), S. 407–438, doi:10.1517/14728214.2012.713345.
- 1 2 P Moreau: The Future of Therapy for Relapsed/Refractory Multiple Myeloma: Emerging Agents and Novel Treatment Strategies. In: Seminars in Hematology. 2012 July;49(1), S. 33–46, doi:10.1053/j.seminhematol.2012.05.004.
- ↑ Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H, Thiele J, Vardiman JW (Hrsg.): WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4. Auflage, IARC Press, Lyon 2008 ISBN 92-832-2431-0 (die WHO-Klassifikation von 2008)
- ↑ J. L. Harousseau, P. Moreau: Autologous hematopoietic stem-cell transplantation for multiple myeloma. In: The New England journal of medicine. Band 360, Nummer 25, Juni 2009, S. 2645–2654, ISSN 1533-4406. doi:10.1056/NEJMct0805626. PMID 19535803. (Review).
- ↑ S. C. Bernstein, A. R. Perez-Atayde, H. J. Weinstein: Multiple myeloma in a child. In: Cancer. Band 56, Nummer 8, Oktober 1985, S. 2143–2147, ISSN 0008-543X. PMID 3928137.
- ↑ Singhal, Seema, Mehta, Jayesh: Multiple Myeloma. In: Clin J Am Soc Nephrol, 2006, 1, S. 1322–1330
- ↑ tk.de/rochelexikon
- ↑ Laura M. Dember: Light Chains, Casts, Sheets and Fibrils: Monoclonal Immunoglobulin Diseases and Immunotactoid/Fibrillary Glomerulopathy. In: Clin J Am Soc Nephrol, 2006, 1, S. 1320–1321
- ↑ Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. In: British Journal of Haematology. 121, Nr. 5, Juni 2003, ISSN 0007-1048, S. 749-757. PMID 12780789..}
- ↑ Pomalidomide Celgene: EPAR - Summary for the public Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) (englisch), abgerufen am 28. August 2013
- ↑ Pomalidomide Celgene: Zusammenfassung des EPAR für die Öffentlichkeit (PDF; 84 kB) EMA - Europäische Arzneimittelagentur (deutsch), abgerufen am 28. August 2013
- ↑ M. Dimopoulos et al.: Lenalidomide plus Dexamethasone for Relapsed or Refractory Multiple Myeloma. In: N Engl J Med. Nr. 357, 2007, S. 2123–2132 (Abstract).
- ↑ D Morse, RC Dailey, J Bunn: Prehistoric multiple myeloma. In: Bulletin of the New York Academy of Medicine. Nr. 50, 1974, S. 447–458, PMID 4594853.
- 1 2 3 W Macintyre: Case of mollities and fragilitas ossium, accompanied with urine strongly charged with animal matter. In: Medical and Chirurgical Transactions of London. Nr. 33, 1850, S. 211–232.
- 1 2 3 RA Kyle: Multiple myeloma: an odyssey of discovery. In: British Journal of Haematology. Nr. 111(4), 2000, S. 1035–1044, PMID 11167737.
- ↑ H Bence Jones: On a new substance occurring in the urine of a patient with mollities ossium. In: Philosophical Transactions of the Royal Society of London (Biology). 1848, S. 55–62.
- ↑ J Dalrymple: On the microscopical character of mollities ossium. In: Dublin Quarterly Journal of Medical Science. Nr. 2, 1846, S. 85–95.
|
|
Dieser Artikel behandelt ein Gesundheitsthema. Er dient nicht der Selbstdiagnose und ersetzt keine Arztdiagnose. Bitte hierzu diesen Hinweis zu Gesundheitsthemen beachten! |